Dalga-parçacık ikiliği? Pauli dışlama ilkesi? Evrenin varlığının anahtarı hangi kuantum kuralıdır
Dalga-parçacık ikiliği? Pauli dışlama ilkesi? En önemli kuantum kuralı hangisidir?
Yeryüzündeki her şey atomlardan ve onların yapı taşlarından oluşur. Bu kural olmadan, asla ilginç bir şey oluşturmazlar.
Çevrenizdeki her şeye bir bakın. Herhangi bir maddenin bileşimini incelemek istiyorsanız, onu sürekli olarak daha küçük parçalara ayırabilirsiniz. Tüm canlı organizmalar tek tek hücrelerden oluşur, bu hücreler karmaşık bir molekül koleksiyonudur ve moleküller atomlardan oluşur. Atomlar ayrıca çekirdek ve elektronlara bölünebilir. Bunlar yeryüzündeki tüm maddenin bileşenleridir ve bu nedenle evrendeki bilinen tüm normal maddemiz de bundan oluşur.

Örnek: Makro ölçekten atom altı ölçeğe kadar, temel parçacıkların boyutu, kompozit yapının boyutunun belirlenmesinde yalnızca küçük bir rol oynar. Bu yapı taşlarının gerçek temel parçacıklar ve / veya nokta parçacıklar olup olmadığı belirsizdir, ancak evreni büyük bir kozmik ölçekten küçük bir atom altı ölçeğe kadar anlıyoruz. (MAGDALENA KOWALSKA / CERN / ISOLDE ekibi)
Bunun nasıl olduğunu merak ediyor olabilirsiniz. Atom çekirdeği ve elektronlardan oluşan, 100'den az çeşit vardır.Atomlar sayısız çeşit molekülü, maddeyi, organizmayı ve bildiğimiz her şeyi nasıl inşa edebilir? Bu yanıtı hafife alınmış bir kuantum kuralına bağlıyoruz: Pauli Dışlama İlkesi.

Örnek: Atomik yörünge temel durumdadır (sol üst köşe) ve en düşük enerjiye sahip bir sonraki durum, sağa ve aşağı hareket ettiğinizde görünür. Bu temel konfigürasyonlar, bu atomların nasıl davrandığını ve aralarındaki kuvvetleri belirler. (Atomik yörüngeler hakkında Wikipedia sayfası)
Çoğumuz kuantum mekaniğini düşündüğümüzde, evrenin tuhaf ve mantık dışı özelliklerini en küçük ölçekte düşünüyoruz. Heisenberg belirsizliğini ve eşleştirilmiş fiziksel özellikleri (konum ve momentum, enerji ve zaman veya iki dikey yönde açısal momentum gibi) eş zamanlı olarak sonlu karşılıklı doğruluğun ötesinde bilmenin imkansız olduğu gerçeğini düşünüyoruz.
Maddenin dalga-parçacık ikiliğini ve kendi davranışlarına müdahale ediyor gibi görünen bireysel parçacıkların (elektronlar veya fotonlar gibi) incelenmesini ele alıyoruz. Sık sık Schrödingerin kedisinden ve kuantum alemindeki birden çok olası sonucun birleşiminden bahsediyoruz. Yalnızca kritik ve kesin ölçümler yaptığımızda, birden çok sonuç belirli bir sonuca doğru çöker.

Örnek: Schrödinger'in kedisi, kuantum mekaniğinin grotesk ve mantıksız doğasını göstermek için tasarlanmış ideal bir deneydir. Kuantum alanı, önemli bir gözlem veya ölçüm yapılana kadar birden fazla durumun üst üste binmesi halinde olabilir, bu sırada yalnızca ölçülebilir bir sonuç vardır.
Çoğumuz Pauli Hariç Tutma İlkesi hakkında pek düşünmedik, basitçe aynı sistemde aynı iki fermiyonun aynı kuantum durumunu işgal edemeyeceğini belirtir.
Çok önemli değil mi?
Aslında bu sadece önemli değil, neredeyse en önemli nokta. Ball atom modelini ilk tanıttığında, basit ama son derece etkiliydi. Elektronları çekirdeğin etrafında hareket eden gezegensel varlıklar olarak ele alarak, ancak yalnızca net bir enerji düzeyinde doğrudan matematiksel kurallarla kontrol edilen modeli, maddenin kaba yapısını yeniden üretir. Noktalar enerji seviyeleri arasında geçiş yaptıkça, fotonları yayar veya absorbe ederler, bu da her bir elementin spektrumunu gösterir.
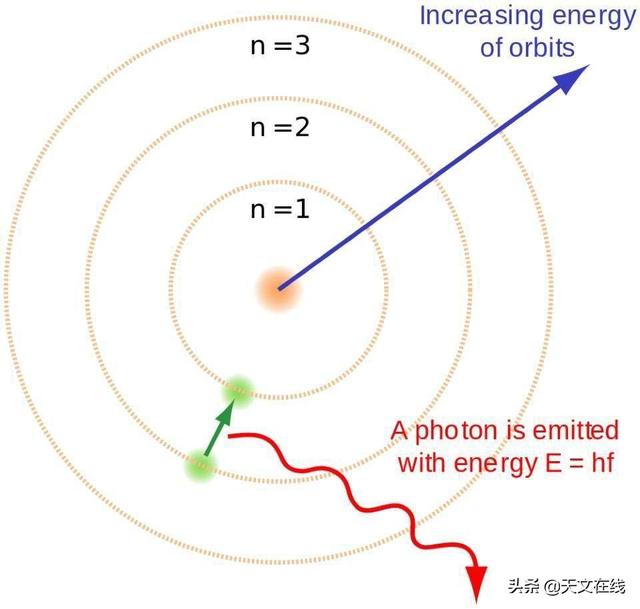
Örnek: Serbest elektronlar hidrojen çekirdeği ile yeniden birleştiğinde, elektronların enerji seviyesi hızla düşecek ve fotonlar yayılacaktır. Kararlılığı sağlamak için, erken evrende oluşan nötr atomların potansiyel iyonlaştırıcı ultraviyole fotonları üretmeden temel durumuna ulaşması gerekir. Boulder atom modeli, kaba bir enerji hiyerarşisi sağlar, ancak onlarca yıl önce görülen şeyi açıklamak için yeterli değildir. (BRIGHTERORANGE ve ENOCH LAU / WIKIMDIA COMMONS)
Pauli'nin uyumsuzluk ilkesi olmasaydı, evrenimizdeki madde tamamen farklı bir biçimde tezahür ederdi. Görüyorsunuz, elektronlar bir fermiyon örneğidir. Her elektron temelde evrendeki diğer atomlarla aynıdır, aynı yüke, kütleye, lepton sayısına, lepton sayısına ve içsel açısal momentuma (veya dönüşe) sahiptir.
Pauli dışlama ilkesi yoksa, atomik temel durumu (en düşük enerji) doldurabilecek elektron sayısında bir sınır yoktur. Zamanla, yeterince düşük bir sıcaklıkta, evrendeki her atom eninde sonunda bu duruma batacaktır. En düşük enerjili yörünge - her atomdaki 1s yörüngesi - elektron içeren tek yörünge olacak ve ayrıca her atomdaki iç elektronları da içerecektir.

Örnek: Sanatçının çizimi, çekirdeğin yörüngesindeki bir elektronu göstermektedir. Elektron temel bir parçacıktır, ancak çekirdek daha küçük, daha temel bileşenlere ayrılmaya devam edebilir. (NICOLLE RAGER FULLER, NSF)
Elbette, evrenimiz böyle çalışmıyor ve bu çok iyi bir şey. Pauli dışlama ilkesi, bunun olmasını önlemek için bu basit ilkeyi kullanır: aynı fermiyonları aynı kuantum durumuna koyamazsınız.
Tabii ki, ilk elektron en düşük enerji durumuna kayabilir: 1s yörüngesi. Bununla birlikte, ikinci elektronu oraya koymaya çalışırsanız, önceki elektronla aynı kuantum numarasına sahip olamaz. Elektronlar, sahip oldukları kuantum özellikleri (kütle, yük, lepton sayısı vb.) Dışında. Çekirdek ile birleştirildiklerinde, enerji seviyesi, açısal momentum, manyetik kuantum sayısı ve spin kuantum numarasını da içerecektir.

Diyagram: Bir elektronun enerjisi, nötr oksijen atomunun mümkün olan en düşük enerji konfigürasyonunu temsil eder. Elektronlar fermiyon olduğundan ve bozon olmadığından, herhangi bir düşük sıcaklıkta bile hepsi temel durumda (1s) var olamazlar. Bu, herhangi iki fermiyonun bir faz kuantum durumunu işgal etmesini engelleyen fiziktir ve çoğu nesne yerçekiminin çökmesine direnir. (WIKIMEDIA ORTAKLARININ CK-12 VAKFI VE ADRIGNOLA)
Çekirdekteki en düşük enerji durumundaki elektron, en düşük enerji seviyesini (n = 1) kaplar ve açısal momentuma (l = 0) sahip olmayacağından, manyetik momentum da 0'dır. Bununla birlikte, elektron rotasyonunun olmaması ikinci bir olasılık sağlar. Atomdaki en düşük enerji durumu (1s) gibi her elektronun spini 1 / 2'dir.
İkinci bir elektron eklediğinizde, o da dönebilir, ancak ters yönde, etkin şekilde -1/2 dönebilir. Bu şekilde, 1s yörüngesine iki elektron yükleyebilirsiniz. Bundan sonra, ilk enerji seviyesi doludur ve sonra üçüncü bir elektron eklemek için bir sonraki enerji seviyesine (n = 2) gitmeniz gerekir. Bu 2s yörüngesi (burada önceki enerji seviyesi olarak l = 0) iki başka elektron tutabilir ve sonra üç manyetik kuantum sayısını tutabileceğiniz 2p yörüngesine (l = 1) gitmeniz gerekir: -1, 0 veya +1 ve her biri elektron dönüşünü +1/2 veya -1 / 2'de tutabilir.

Örnek: her bir yörünge (kırmızı), her bir p yörünge (sarı), her bir d yörünge (mavi) ve her bir f yörünge (yeşil) yalnızca iki elektron tutabilir: biri yukarı doğru dönen ve biri bakan Aşağı döndürün. (LIBRETEXTS KÜTÜPHANESİ / NSF / UC DAVIS)
Pauli dışlama ilkesi - ve evrenimizde kuantum sayılarımız olduğu gerçeği - her atoma kendi benzersiz yapısını verir. Atoma daha fazla elektron ekledikçe, her elektron için bir konum bulmak için daha yüksek enerji seviyelerine, daha büyük açısal momentuma ve daha karmaşık yörüngelere gitmemiz gerekir. Bu enerji seviyelerinin çalışma şekli aşağıdaki gibidir:
- En düşük enerji seviyesi (n = 1) yalnızca s orbitallerine sahiptir, açısal momentumu yoktur (l = 0) ve yalnızca iki elektron barındırabilir (dönüş +1/2 ve 1/2)
- İkinci enerji seviyesi (n = 2) s orbitallerini ve p orbitallerini içerir. 0 (l = 0) veya 1 (l = 1) açısal momentuma sahip olabilir. Bu aynı zamanda 2s yörüngesinde olabileceğiniz anlamına gelir (2s yörüngesinde Dönüşleri +1/2 ve -1/2 olan elektronları yerleştirebilir ve iki elektronu 2p orbitallerine (manyetik kuantum sayıları-1, 0 ve +1, her biri +1/2 spin içeren ve -1/2 elektron) 6 elektron tutabilir.
- Üçüncü enerji seviyesi (n = 3) s, p ve d orbitallerine sahiptir. D orbitalinin açısal momentumu 2'dir (l = 2), bu nedenle manyetik kuantum sayısı beşe (-2, -1, 0, +1) ulaşabilir. , +2), 3s orbitallerine (iki elektron barındıran) ve 3p orbitallerine (altı elektron barındıran) ek olarak toplam 10 elektron yerleştirilebilir.

Örnek: Enerji seviyeleri ve elektron dalgası fonksiyonları, tüm atomik yapılar son derece benzer olmasına rağmen, hidrojen atomlarındaki farklı durumlara karşılık gelir. Enerji seviyesi Planck sabiti ile ölçülür, ancak yörüngedeki atomun boyutu, temel durum enerjisi ve elektronun kütlesi tarafından belirlenir. Ek etki çok küçük olabilir, ancak enerji seviyesi ölçülebilir ve ölçülebilir bir şekilde kavramsallaştırılabilir. (WIKIMEDIA ORTAKLARIN POORLENO)
Bu temel kuantum kuralı uyarınca, periyodik tablodaki her atom diğer atomlardan farklı bir yapıya sahip olacaktır. En dıştaki kabuktaki elektronik özellikler onun fiziksel ve kimyasal özelliklerini belirlediğinden, her atomun kendine özgü atomu, iyonu ve moleküler bağı vardır.
İki unsur ne kadar benzer olursa olsun, oluşturdukları yapı bakımından farklıdırlar. Bu nedenle karmaşık yapılar inşa etmek için birkaç basit malzeme kullanabiliriz. Eklediğimiz her yeni elektronun, önceki elektrondan farklı bir kuantum numarasına sahip olması gerekir, bu da atomların diğer tüm maddelerle etkileşimini değiştirecektir.

Örnek: Atomların organik moleküller ve biyolojik süreçler de dahil olmak üzere moleküllere bağlanma şekli, Pauli'nin elektronları yönetmeye yönelik uyumsuzluk ilkesi nedeniyle mümkündür. (JENNY MOTTAR)
Sonuç, her bir atomun, atomların kimyasal veya biyolojik bileşikler oluşturması için sayısız olasılık sunmasıdır. Atomların nasıl birleştirilebileceğinin bir sınırı yoktur. Elbette bazı yapılar daha fazla enerjiye ihtiyaç duyar, doğada çeşitli enerji koşulları vardır ve bu bileşiklerin oluşmasına zemin hazırlar, en zeki insanlar bile bunu düşünemez.
Atomları birleştirerek birçok harika bileşik oluşturabiliriz.Atomların bu davranışı sergilemesinin tek nedeni, aynı kuantum durumuna herhangi bir sayıda elektron koyamamaktır. Elektronlar fermiyonlardır ve Pauli'nin tam olarak anlaşılmamış kuantum kuralı, herhangi iki özdeş fermiyonun aynı sayıda kuantum sayısına sahip olmasını engeller.

Resim: Beyaz cüceler, nötron yıldızları ve hatta en garip kuark yıldızları fermiyonlardan yapılmıştır. Pauli dejenerasyon baskısı, tüm yıldız kalıntılarının kütleçekimsel çöküşe direnmesine ve kara delikler oluşturmasını önlemesine yardımcı olur. (CXC / M.WEISS)
Birden fazla fermiyonun aynı kuantum halini elde etmesini önlemek için Pauli'nin dışlama ilkesine sahip olmasaydık, evrenimiz çok farklı olurdu. Hemen hemen her atom bir hidrojen atomu ile aynı özelliklere sahiptir ve birleştirilebilen yapı son derece basittir. Pauli'nin dışlama ilkesinin sağladığı yozlaşmış baskı altında var olan beyaz cüceler ve nötron yıldızları da kara deliklere dönüşecek. Daha da korkutucu olan, tüm yaşamın temeli olan tüm karbon bazlı bileşiklerin var olmayacak olmasıdır.
Gerçekliği yöneten kuantum kurallarını düşündüğümüzde, Pauli'nin dışlama ilkesi genellikle ilk değil, ama olmalı. Kuantum belirsizliği veya dalga-parçacık ikiliği olmadan, evrenimiz farklı olacak, ama yine de var olacak. Bununla birlikte, Pauli uyumsuzluk ilkesi yoksa, hidrojen ile bu benzer moleküller arasındaki moleküler bağlar
Anahtar oluşumu son derece karmaşık hale gelecektir.
Referans
1. Wikipedia Ansiklopedisi
2. Astronomik terimler
3. Ethan Siegel- dengesi
İlgili herhangi bir içerik ihlali varsa, silmek için lütfen 30 gün içinde yazarla iletişime geçin
Lütfen yeniden basım için yetki alın ve bütünlüğü korumaya ve kaynağı belirtmeye dikkat edin
-
- Çin borsası: Boğa ve ayıların tarihsel yasalarını anlarsanız, A hisseleri yeni bir yavaş boğa piyasası turu başlatacak mı? Düşersen, daha çok alırsan ve ayrılırsan son gülen kim olacak?
-

- Çalar saat hazır! Bu gece, batıdaki gece gökyüzü ayın tadını çıkarabilir ve Bisuyi ve Bisuwu'nun iki göksel fenomenini ayla kaplayabilir.
-

- Tarih her zaman şaşırtıcı derecede benzerdir: Bir sonraki boğa piyasası geliyor, krupiye ile pozisyon açarken hisse senedi satın almak istediğinizde bu 4 beceriyi aklınızda tutmalısınız.
-

- Çin borsası: "Geç ticarette yarım saat" yarın yükseliş ve düşüşü değerlendiriyor! Bu şimdiye kadar gördüğüm en kapsamlı analiz edilen ticaret makalesi
-

- 3 dakikada 3700 hisse senedi arasından güçlü hisse senetleri nasıl seçilir, "KDJ + BOLL" çift endeksli rezonans "hisse senedi seçme yöntemini aklınızda tutun ve yalnızca bir kez paylaşın