Tanrı petrol ülkesinin sihirli tıbbının efsanesi

Son iki gün içinde, Xu Zheng ve Ning Hao, Xu Zheng'in başrol oynadığı ve ülke çapında resmi olarak vizyona giren bir komedi filmi olan "I'm Not the God of Medicine" i birlikte yaptılar. Gösterim aşamasında halkın beğenisini kazanan bu filmin gülüp gözyaşları içerdiği söylenebilir, hatta bazı film eleştirmenleri onu "şimdiye kadarki en iyi yerli film, onlardan biri değil" olarak nitelendirdi.
Senaryo ders kitabı, iyi bir filmin insanlığı ifade etmesi gerektiğini ve insanlığın ancak büyük seçimlerle karşı karşıya kaldığında, özellikle de yaşam ve ölümle yüzleştiğinde ortaya çıkabileceğini söylüyor. "Ben bir tıp tanrısı değilim" de anlatılan hikaye, yaşam ve ölümle ilgilidir ve özü, kanseri tedavi edebilen özel bir ilaç olan "Glenin" dir. Bu ilacın orijinal ürünü çok pahalıdır, bu nedenle Xu Zheng'in oynadığı uyuşturucu satıcısı Hindistan'dan yerli hastalara ucuz jenerik ilaçları satmaya başladı ve hikaye ortaya çıktı.
Xu Zheng'in filmleri için film eleştirileri yazmak için başka bir fırsat bulabilirim belki. Basitçe söylemek gerekirse, bu film en az bir milyar gişe ile popüler olacak. Ne kadar bilim yazılırsa o kadar iyi bir film kadar iyi olmadığına iç çekmeliyim. Korkarım ki birçok insan bu film aracılığıyla yeni bir uyuşturucu anlayışına sahip olacak.
Ne var ki filmler bilim değil, filmdir. Film, karakterlerin seçimi ve kaderi üzerine odaklanıyor.Filmdeki "ana karakter" Glenin hakkında daha fazla bilgi edinmek istiyorsanız, lütfen Kingdom of God Oil'in sihirli ilacının arkasındaki hikayeyi dinleyin.
Gleevec kan kanserini yavaşlatıyor
Bazı insanlar Glenin'in hayali bir ilaç olduğunu düşünebilir, ama aslında kanser karşıtı ilaçlar hakkında biraz bilgi sahibi olan herkes, Glenin'in filmdeki "oyununun" büyülü bir anti-kanser ilacı-Gleevec olması gerektiğini bilecek. Avrupa ticari adı Glivec, ABD ticari adı Gleevec ve asıl ilaç molekülü Imatinib'dir.
Gleevec gerçekten de "sihirli bir ilaçtır" : Hastanın bu ilaca yanıt oranı neredeyse% 100'dür; uzun süreli kullanım ilaca karşı direnç oluşturmaz; tedavi edilebilen hastalık yelpazesi genişlemeye devam etmektedir. Daha da önemlisi Gleevec, hayatta kalma umudu çok az olan kanseri, ilaç alarak kontrol altına alınabilecek kronik bir hastalığa dönüştürdü. Elbette "Tanrı" nın da yüksek bir bedeli var.
Gleevec neden bu kadar tanrısal? Bu makale size hikayeyi ayrıntılı olarak anlatacaktır. Öncelikle, Gleevec'in esas olarak tedavi ettiği kanser türünü tanıtmalıyım - kronik miyelojenöz lösemi (KML). Sözde lösemi kan kanseridir. Kanser hücrelerinin birçok genetik mutasyon biriktirmiş ve sonsuza kadar çoğalabilen hücreler olduğunu biliyoruz. Spesifik olarak KML için, hastaların kanında genetik mutasyona sahip hücreler çeşitli granülositlerdir.
Granülositler, beyaz kan hücrelerindeki ana güçtür.Örneğin, en yüksek orana sahip nötrofiller tüm beyaz kan hücrelerinin% 40 ila% 70'ini oluşturabilir. Nötrofiller, bağışıklık sistemimizdeki doğuştan gelen bağışıklıktan sorumlu ana güçlerden biridir. Vücudunuz hasar gördüğünde nötrofiller hasarlı bölgeye on ila yirmi dakika içinde ulaşabilir ve istila eden patojenler gibi yabancı cisimleri yutabilir.
Kan hücrelerinin esas olarak kemik iliğinde "üretildiğini" biliyoruz. KML hastalarının kemik iliğinde hematopoietik hücreler anormaldir ve çok sayıda granülosit kontrolsüz olarak üretilir. Sadece buysa, sorun çok ciddi değildir. Ancak bu kanser patlama aşamasına ilerlediğinde, kemik iliğindeki granülositler, normal hematopoietik hücrelerin yaşam alanını sıkıştırarak keskin bir şekilde artar. Biliyorsunuz, kanımızdaki çeşitli kan hücrelerinin ömrü çok sınırlıdır, mesela kırmızı kan hücrelerinin ömrü dört aydan azdır. Bu nedenle bu kan hücrelerinin zaman zaman yenilenmesi gerekir. Bu nedenle, KML hastalarının normal hematopoietik hücreleri azaldığında, vücut kaçınılmaz olarak çeşitli ciddi semptomlara sahip olacaktır, buna bağışıklık fonksiyonunun kaybı da dahildir ve bu da sonunda hastanın ölümüne yol açacaktır.
KML "kronik" bir isim taşısa da kesinlikle hafife alınabilecek bir kanser değildir. Kanser belirli bir doku veya organda ortaya çıkarsa, cerrahi rezeksiyon veya hedefe yönelik radyoterapi ve kemoterapi genellikle sorunu çözebilir. Ancak KML, kemik iliğinde ve kanda oluşur ve yukarıdaki yöntemlerle tedavi edilemez.
Bu makalenin baş kahramanı olan "sihirli ilaç" Gleevec'ten önce, KML için tek etkili tedavi, yüksek riskli kemik iliği nakliydi. . Bu aynı zamanda birçok yerli TV dizisinde ortak bir bölümdür ve içindeki zorluklar ve tehlikeler muhtemelen herkese aşinadır. Kemik iliği nakli ile tedavi edilemiyorsa, KML'nin hayatta kalma süresi sadece 3 ila 5 yıldır. Kullanılabilecek ana ilaç tedavisi interferondur ancak hastaların ömrünü ancak% 20 ila% 30 arasında bir yıl uzatabilir.
Gleevec'in ortaya çıkışından sonra, farklı araştırma kurumları Gleevec kullanan KML hastaları üzerinde uzun yıllar takip araştırmaları yürüttüler ve sonuçlar sadece "sihirli" olarak tanımlanabilir. İlaç tedavisinden sonra hastaların beş yıllık sağkalım oranı yaklaşık% 90 kadar yüksektir ve ölüm nedeninin ölümlerinin çoğunun kanserle hiçbir ilgisi yoktur.Hastaların sadece yaklaşık% 1'i löseminin kötüleşmesinden ölür. Gleevec'in kötü huylu bir kanseri sadece ilaç alarak kontrol edilebilen kronik bir hastalığa dönüştürdüğü ve nihayet KML'deki "kronik" adını gerçeğe dönüştürdüğü söylenebilir.
Philadelphia Kromozom Değişimi
Gleevec neden bu kadar güçlü? Bu, KML'nin temel nedeninden başlamalıdır.
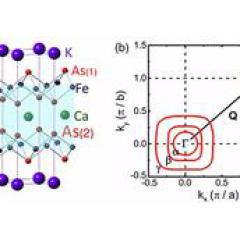
1950'lerin sonlarında, Philadelphia'daki Pennsylvania Üniversitesi Tıp Fakültesi'nden patolog Peter Nowell, lösemi hastalarının beyaz kan hücrelerini incelerken, yanlışlıkla çekirdekteki kromozom morfolojisinin anormal olduğunu keşfetti. Her zaman cinsiyet kromozomlarının X ve Y şeklinde bölündüğünü söylememize rağmen, aslında diğer 22 çift kromozomumuzun hepsi X harfine benziyor, ancak X'in iki darbesi arasındaki açılma açısı büyük değil, daha çok tek bir Yazılı H. Ancak Nowell, bazı hastaların beyaz kan hücrelerindeki kromozomların büyük bir açı açtığını buldu.
Nowell, ne olduğunu öğrenmek için Philadelphia'daki Fox Chase Kanser Merkezi'nde kromozomlar üzerine çalışan bir doktora öğrencisi David Hungerford'dan yardım istedi. Sonuncusu çok sayıda gözlem ve araştırma yaptı ve bu lösemi hastalarının beyaz kan hücrelerindeki anormal kromozomun 22. kromozom olduğu sonucuna vardı. Sadece X şeklindeki ayrılma açısı anormal derecede genişlemekle kalmadı, aynı zamanda kromozomun kendisi de kısaldı. Bu nedenle, bu anormal kromozom, iki kaşifin bulunduğu şehrin adını aldı ve Philadelphia kromozomu olarak adlandırıldı.
Philadelphia kromozomunun keşfi nedeniyle, lösemi, insanlık tarihinde genetik anormallik kanıtının bulunduğu ilk kanser oldu. Bununla birlikte, Philadelphia kromozomunun kökeni hala bilinmemektedir. Farklı laboratuvarlarda onlarca yıllık araştırmalardan sonra, bilim adamları bunu daha derin bir şekilde anladılar. Aslında, kromozom 22, anormallikleri olan tek kromozom değildir.Kromozom 9'da da bir anormallik vardır, ancak anormal derecede daha uzundur. 9. kromozomun uzun kolunun bir kısmının, 22. kromozomun uzun kolunun bir kısmıyla değiştirildiği ortaya çıktı. Sonuç olarak, ilki uzar ve ikincisi kısalır.
Ne yazık ki, iki kromozom üzerindeki kırılma noktaları bir genin içindedir: Kromozom 22'deki BCR geni ve kromozom 9'daki ABL1 geni. Bu nedenle, değişimden sonra, kimerik kromozom 22'de bir füzyon geni, yani BCR ve ABL1'in çoğunu tutan, birbirine bağlı iki genin oluşturduğu bir gen ortaya çıktı, bu nedenle BCR-Abl geni olarak adlandırıldı.
Genlerin proteinleri kodlamak için kullanıldığını biliyoruz ve bu BCR-Abl geni, normal insan hücrelerinde bulunmayan BCR-Abl adı verilen kimerik bir protein üretecektir. Kromozom 9 ve 22 arasındaki translokasyonun spesifik konumu sabit olmadığından, farklı lösemi hastalarının beyaz kan hücrelerinde bulunan BCR-Abl proteini farklıdır. Bunların arasında, moleküler ağırlığı 210 kDa (kilodalton) olan BCR-Abl proteini, KML'nin% 90'ına neden olan suçludur.

Moleküler anahtar
Bir BCR-Abl kimerik proteini neden dalgalar oluşturabilir? Çünkü bu kimerik protein bir anahtar, hücre bölünmesini ve çoğalmasını kontrol eden bir anahtar.
Bozulmamış Abl proteini, bir tirozin kinazdır. Sözde kinaz, substrat proteinine bir fosfat grubu ekleyebilen bir enzimdir ve bu işleme fosforilasyon denir. Fosforik asit grubu çok iyi bir adamdır, güçlü bir negatif elektriğe sahiptir, tüm pozitif yüklü şeyleri çekebilir. Bu, ayağınızda manyetik bir pozitif elektrot bulundurmak gibidir, şimdi güçlü bir mıknatısın manyetik negatif elektrodunu elinizle tutarsanız, eliniz kesinlikle ayağınıza çekilecektir. Protein fosforile edildikten sonra, pozitif yüklü kısım ve fosforik asit grubu sıklıkla birbirine çekilir, bu nedenle önemli şekil değişiklikleri meydana gelir ve bu da proteinin işlevini etkiler.
Aslında hücrelerimizde birçok kinaz zinciri vardır. Kinaz A, fosforilasyondan sonra aktive edildikten sonra, kinaz B'yi defosforile etme yeteneğine sahiptir. Kinaz B, fosforilasyondan sonra aktive edildikten sonra, kinaz C'yi defosforile etme kabiliyetine sahiptir. Bu şekilde hücredeki sinyal sonsuza kadar iletilebilir. Böyle bir sinyal yolunun kinaz kaskad adı verilen canlı bir adı vardır veya daha az ilgi çekici olan kinaz kaskad olarak çevrilebilir.
Elbette bazı kinazlar diğer kinazlar tarafından aktive edilmez, örneğin Abl böyle bir kinazdır. Başı, kendi enzim aktivite merkeziyle birleşen kapak şeklinde bir alana sahiptir ve bütünü hareketsiz hale getirir. Abl'in aktive olması için hücredeki diğer proteinlere ihtiyacı vardır. Hücrenin Abl aktivitesini böyle "değiştirmesi" budur.
Bununla birlikte, anormal füzyon proteini BCR-Abl, CML hastalarının hücrelerinde ortaya çıktı. Genleri kaynaştığında, Abl geriye yaslandı ve baskılayıcı baş örtüsüne karşılık gelen yarım geni kromozom 9'a düşürdü, bunun yerine BCR geninin işe yaramaz yarısını kromozom 22'de değiştirdi. Sonuç olarak, BCR-Abl'deki Abl, her zaman açık olan bir kinaz haline gelir. Buna uygun olarak, BCR-Abl'li hücreler anormal bir bölünme ve çoğalma durumundadır ve kanser hücreleri haline gelir.
Gleevec'in doğuşu
KML'nin nedenini anladıktan sonra, kahramanımız Gleevec nihayet çıkış yapmak üzere.
Geçen yüzyılın ikinci yarısında kanser neredeyse tedavi edilemez bir hastalıktı. Az sayıda şanslı hasta temelde ameliyat, radyoterapi ve kemoterapi ile tedavi edilebilir, ancak çoğu kanser hastası o kadar şanslı değildir. İkincisi için, doktorlar iki şeyden fazlasını yapamazlar: Biri hastanın acısını hafifletmek, diğeri hastanın yaşamını sınırlı bir şekilde uzatmaktır. Ancak bazı doktorlar artık bundan memnun değildi. Biyolojinin hücreler hakkındaki anlayışı kademeli olarak gen ve protein düzeyine ulaştığından, bilim adamları CML gibi bazı kanserlerin kesin nedenini zaten biliyorlar, böylece sıradan yerine daha hedefli tedaviler arayabilirler. Tüm hücreleri ayrım gözetmeden öldüren kimyasal ilaçlar.
Tıp ve biyoloji alanında çift diploması olan Profesör Brian Druker, tam bir kanser araştırmacısıdır. 1988'de, Oregon Sağlık ve Bilim Üniversitesi'ne kendi laboratuvarını kurmak için yeni gelmişti.İsviçreli bir ilaç şirketi olan Ciba-Geigy'de bir bilim insanı olan Dr. Nicholas Lydon, hedefe yönelik bir anti-kanser geliştirmek için onunla işbirliği yapmayı umarak ona yaklaştı. kimya tıbbı. Bu yüzden Druker, Lydon'a, en iyi seçeneğin KML üzerinde araştırma yapmak olduğunu çünkü moleküler mekanizması o zamanlar temelde anlaşılmıştı. Daha da önemlisi, bu kansere neden olan BCR-Abl proteini, anormal gen füzyonunun sonucudur, bu nedenle normal hücrelerde görünmeyecektir. Bu şekilde BCR-Abl için geliştirilen ilaçlar normal hücreler üzerinde çalışmayacaktır.
Bu şekilde Druker ve Lydon, CML hasta hücrelerinde BCR-Abl proteinini hedefleyen bir işbirliği başlattı. Kısa süre sonra Lydon, terapötik bir hedef olarak iltihaplanma ile inşa edilmiş küçük moleküllerden oluşan bir kitaplık aldı. Bu kütüphanedeki küçük molekülleri tek tek test etmek ve taramak için kullandılar ve sonunda CML hastalarında anormal granülositleri etkili bir şekilde öldürebilen STI571 numaralı bir bileşik buldular.
Şu anda bulunan bileşik bir ilaca eşdeğer değildir, ancak genellikle bir kurşun bileşik olarak adlandırılır. Bu bileşiğin hedef hücreler üzerinde öldürücü etkisi olmasına rağmen, insan vücuduna girdikten sonra insan vücudu tarafından hızlı bir şekilde metabolize edilmesi veya vücudun detoksifikasyon mekanizması tarafından hiçbir ilaç aktivitesi olmayan küçük moleküllere dönüştürülmesi gibi çeşitli durumların ortaya çıkması kaçınılmazdır. İnsan vücudu için ciddi derecede zehirlidir. Bu nedenle, öncü bileşiğin hayvan deneyleri ve klinik deneylerle daha fazla değiştirilmesi ve doğrulanması gerekir. Ne yazık ki, birçok bileşik bu deneylerde başarısız olur ve sonuçta ilaç haline gelemez. STI571, basit bir modifikasyondan sonra hayvan deney aşamasına girdiği için şanslı.
1990'larda insanlar kanser ilacı araştırması için çaresizdi. Amerikalı bir kanser araştırmacısı bir keresinde şaka yaptı: "Kanser üzerine insan araştırmalarının tarihi, fare kanserini tedavi etme tarihidir." Bunun anlamı, birçok ilacın hayvan deneylerinde iyi etkilere sahip olduğu ve hayvanlardaki kanserleri etkili bir şekilde tedavi edebildiği, ancak insan kanserlerine karşı tamamen etkisiz olduklarıdır.
Gleevec'in durumu bunun tam tersidir. Pek çok hayvan türünde, özellikle köpeklerde bazı istenmeyen yan etkiler gösterdi, şiddetli karaciğer reaksiyonu deneye katılan köpekleri neredeyse öldürdü. Bu projenin ölmek üzere olduğunu gören maymunlar üzerindeki deney başarılı oldu ve Gleevec'in hikayesinin devam etmesine izin verdi.
Ancak iyi şeyler uzun zaman alır. Gleevec, insan klinik araştırmalarına girmek üzereyken, şirket düzeyinde büyük değişiklikler meydana geldi. Lydon'un Ciba-Geigy şirketi, günümüzün uluslararası ilaç endüstrisinin devi Novartis'i (filmde Novartis) oluşturmak için başka bir ilaç şirketi ile birleşti. Lydon da bu kargaşada şirketten ayrıldı ve birleşmeden sonra yeni şirket, klinik olarak henüz yapılmamış bu projeyle daha az ilgileniyor gibi görünüyor.
Neyse ki Druker, Novartis'in CEO'sunu Gleevec'in klinik aşamaya girmesine izin vermesi için ikna etmekte ısrarcı bir kişi. Druker gerçekten de Şans Tanrıçası'nın lütfunu almıştır.İlaçları, klinik deneylerin ilk aşamasında mükemmel etkinlik göstermiştir. Denemeye katılan tüm KML hastaları Gleevec'e% 100 yanıt vermiştir. Böylesine yüksek bir yanıt oranı, anti-kanser ilaçlarının araştırılması ve geliştirilmesinde benzeri görülmemiş bir mucizedir.
Kısa süre sonra, hala test edilmekte olan "sihirli ilaç" olan Gleevec'in ünü KML hastaları arasında yayıldı. Novartis CEO'sunun önünde yığılmış klinik araştırmaya katılma talepleri. Sonuç olarak, Gleevec'in Faz II ve Faz III klinik denemeleri başarıyla başlatıldı.
Son olarak, Mayıs 2001'de ABD Gıda ve İlaç Dairesi (FDA) Gleevec'i KML tedavisi için bir ilaç olarak onayladı. Şu anda, Druker ve Lydon'un ilk tanışmasının üzerinden 13 yıl geçti ve Novartis'in FDA'ya ilaç pazarlama başvurusu sunmasının üzerinden iki buçuk yıl geçti.

Aklın zaferi
Gleevec'in satışı toplumda büyük bir tepki uyandırdı. Onaylandığı ay, Amerika Birleşik Devletleri'nde Time Magazine'in kapağında çıktı ve onu devrimci bir ilaç olarak nitelendirdi ve kansere karşı savaşta yeni bir silah olarak selamlandı.
Biliyorsunuz, Gleevec'in tedavi ettiği KML, yüksek insidanslı bir kanser değildir. 2014 yılında resmi olmayan kuruluşların istatistiklerine göre, Çin anakarasında KML görülme sıklığı 100.000 yetişkinde birden azdır. Batı ülkelerindeki insidans oranı biraz daha yüksektir, ancak 100.000'de 2'den fazla değildir. Gleevec, bu kanserin ölüm oranını neredeyse sıfıra düşürse bile, kanseri fethetmekten uzaktır. Öyleyse insanlar neden bu kadar ciddiye alıyor?
Her şeyden önce, esas olarak KML'yi tedavi eden bir tür anti-kanser ilacı olan Gleevec, gerçekten "sihirli ilaç" adını taşıyor. Yukarıda bahsedildiği gibi, Gleevec, KML hastalarının beş yıllık hayatta kalma oranını normal popülasyonun yaklaşık% 30'undan% 90'ına çıkararak kanseri kronik bir hastalığa dönüştürebilir. Ayrıca Gleevec, diğer kemoterapi ilaçları kadar dirençli değildir. Başka bir deyişle, kanser hücreleri nasıl mutasyona uğrarlarsa olsunlar Gleevec'in öldürme etkisinden kaçamazlar. Ayrıca, KML hastalarının Gleevec'e yanıt oranı çok yüksektir,% 100'e yakındır. Oldukça az sayıda anti-kanser ilacının sadece karşılık gelen kanser hastalarının bazıları üzerinde etkili olabileceği ve bu hastalıktan muzdarip olan diğer hastalar üzerinde hiçbir etkisi olmadığı anlaşılmalıdır. Daha da şaşırtıcı olan şey, BCR-Abl'i hedefleyen bu tür ilaçların aynı zamanda "hedef dışı" koşullar göstermesi ve CML hariç birçok kanser üzerinde iyi iyileştirici etkiler göstermesidir. Şu anda Gleevec, on farklı kanserin tedavisi için FDA tarafından onaylanmıştır. Hatta bazı araştırmacılar Gleevec'in diyabet üzerinde belirli bir etkisi olduğunu bildirdi.
İkincisi, yaşam bilimleri araştırmaları açısından bakıldığında Gleevec, insanlık tarihinde rasyonel olarak tasarlanmış ilk ilaçtır. Gleevec'ten önce, uyuşturucu araştırma ve geliştirmede ortak bir söz kullanırdık: "Nerede savaşmalı". Örneğin, 1960'lar ve 1970'lerdeki antibiyotik keşfi döneminde, hücrelerinde yepyeni bir antibiyotik bulma umuduyla, temelde tanıdık olmayan mikroorganizmaları aramak için alışılmadık yerlere gidiyordu. Bu sürecin özü "irrasyonel" dir. İlaç şirketinin nihayet tedavi etmek için pazarladığı birçok hastalık bile, ilaç şirketinin onu ilk geliştirdiklerinde tedavi etmeyi umduğu hastalıklar değildir: Örneğin, küçük mavi hap "Viagra" tipik bir örnektir.
Gleevec farklıdır ve "nereye vurulacağı" modeli olarak adlandırılabilir. Araştırma ve geliştirmesi en başından beri KML'ye, hastalığın genetik mutasyonundan mutant proteine ve küçük moleküllerin inhibisyonuna kadar adım adım rasyonel bir temele sahiptir, bu nedenle rasyonel olarak tasarlanmış bir ilaç olarak adlandırılır. Druker ve Lydon, rasyonel ilaç tasarımındaki öncü çalışmaları nedeniyle 2009 yılında biyoloji ve tıp alanında "Nobel Weathervane Ödülü" olarak bilinen Amerikan "Lasker Ödülü" nü de kazandı.
Aslında bugünün ilaç gelişimi daha da iyi olabilir.
Gleevec'in satışa çıkmasından sadece ikinci yıl sonra, proteinlerin üç boyutlu yapısını inceleyen yapısal biyologlar, kompleksin yapısını Gleevec ve inhibe ettiği BCR-Abl proteini tarafından birbirine yakın bir şekilde bağlı olduğunu bildirdi. Aslında Gleevec'teki her atomun BCR-Abl ile nasıl birleştiğini ve nasıl çalıştığını "görüyorum". Bu noktada, Gleevec'in bilimsel hikayesi tamamen tamamlanmıştır.
Bununla birlikte, düşüncemizi tersine çevirirsek: Önce BCR-Abl'in yapısını alabilirsek, aktif merkezinin şekline ve şarjına göre küçük bir ilaç molekülü tasarlayabilir, doldurabilir ve engellemesi için engelleyebilir miyiz? İşlev ne olacak? Eğer yapılabilirse, Gleevecin Ar-Ge sürecinin son kısmı - yani küçük molekül kitaplıklarının taranması - "rasyonel tasarım" olur. Bu yönteme "yapı bazlı ilaç tasarımı ve modifikasyonu" adı verilir.
Yeni yüzyıldan beri pek çok araştırma kurumu ve ilaç şirketi bu fikri ilaç moleküllerini tasarlamak ve geliştirmek için kullandı. Ne yazık ki, birkaç başarılı vaka var. İnsanların, protein molekülleri mikroskobik dünyadaki diğer küçük moleküller ile birleştirildiğinde ne olacağı konusunda hala çok sınırlı bir anlayışa sahip olduğu söylenmelidir ki bu, karşılık gelen ilaç tasarımına büyük engeller getirmiştir. Ancak, yapı temelli ilaç tasarımının gelecekteki ilaç geliştirme için önemli bir yön olduğuna şüphe yoktur.

"İnsanlık dışı" ilaç fiyatları
Gleevec kanser tedavisinde ne kadar başarılı olursa olsun ve ilaç geliştirme tarihinde ne kadar önemli olursa olsun, "Ben tıp tanrısı değilim" filminin "kahramanı" olmasının nedenleri bu olmayabilir. Aslında, Gleevec hakkında konuştuğu sürece, pahalı fiyatı sorunundan kaçınmak imkansızdır. Fiyat sorunu yoksa bu filmin hikayesi söz konusu olmayacak.
Gleevec, doğumunun başında çok pahalıydı ve Birleşik Devletler'de bir yıllık düzenli ilaçların maliyeti 30.000 dolardı. Bununla birlikte, 2012 yılına kadar, bir yıllık düzenli ilaçların maliyeti 92.000 ABD dolarına ulaşarak Novartis'in gelirini 4.7 milyar ABD dolarına kadar çıkardı. Ortalama bir Amerikalının yıllık geliri onbinlerce dolar civarındadır. 92.000 ABD doları gibi yüksek ilaç maliyeti, sıradan aileler için kesinlikle uygun değildir.
2013'te 100'den fazla kanser araştırma uzmanı, tanınmış akademik dergi "Blood" da Gleevec dahil yeni anti-kanser ilaçlarının fiyatının hastaların karşılayamayacak kadar yüksek olduğunu iddia eden ortak bir mektup yayınladı. "İnsanlık dışı" davranış olduğu söyleniyor. Bu uzmanlar arasında, Gleevec'in erken gelişimine önemli katkılarda bulunan Brian Druker gibi bilim adamları da var. Aslında Druker'in kendisi Gleevec ile ilgili herhangi bir patent başvurusunda bulunmadığı gibi Gleevec'in satışından da kar elde etmedi.
Ancak, akademisyenlerin itirazları açıkça Novartis tarafından duyulmayacaktır. The Washington Post tarafından 2016 yılında yayınlanan bir rapora göre, Gleevec'in bir yıllık toptan satış fiyatı, kabaca 800.000 RMB'ye eşit olan 120.000 ABD Dolarına ulaştı.
Nerelisiniz?
Gleevec gibi ilaçlar neden bu kadar pahalı?
Öncelikle üretim maliyeti kesinlikle sorun değil . Komşu ülkemiz Hindistan, büyük miktarda Gleevec jenerik ilaç üretiyor, fiyat orijinal ilaçların sadece% 5 ila% 10'u. Hindistan'dan jenerik Gleevec satın almak, bir aylık ilaç için yalnızca bir veya iki bin yuan'a mal oluyor, bu da gerçek ilaçların fiyatından çok uzak.
Öyleyse, yüksek ilaç fiyatlarının nedeni Ar-Ge maliyetleri mi? Evet değil. Örnek olarak Gleevec'i ele alalım. 13 yıllık araştırma ve geliştirme, milyarlarca dolara ulaşan büyük yatırımlar harcadı. Ancak, Druker gibi uzmanlar 2013'te açık bir mektupta, Novartis'in 2001'de halka açıldığında fiyatına Gleevec'in araştırma ve geliştirme maliyetini sadece 2 yıl içinde geri alabileceğini belirttiler.
Ancak ilaç firmasının hesabı bu şekilde hesaplanmaz. Gleevecin araştırma ve geliştirme öyküsünde, ilaçların geliştirilmesinde pek çok aşama olduğunu ve her aşamanın büyük bir eliminasyon oranına sahip olduğunu görebiliyoruz. Başka bir deyişle, birçok ilacın geliştirilmesi pazarı karlı hale getirmekte başarısız oluyor. Çeşitli ilaç şirketlerinin Ar-Ge planları gizli tutulduğundan, başarısız olan Ar-Ge projelerini ve maliyetlerini doğru saymak zordur. Ancak genel olarak konuşursak, her 100 ilaç araştırma ve geliştirme projesinde sadece bir başarılı olabilir, hatta hiç olmayabilir.
Kabaca bir hesaplama da yapabiliriz, her projenin ilaç firmaları için araştırma ve geliştirme masraflarına ortalama 100 milyon dolar harcadığını varsayarsak, 100 proje 10 milyara mal olur. Ancak, başarısız olan 99 firmadan hiçbiri herhangi bir kar sağlamaz ve sadece başarılı olan bu maliyetleri paylaşabilir. Diğer bir deyişle, bu başarılı projenin doğrudan Ar-Ge maliyeti 500 milyon hatta 1 milyar olabilir, ancak ilaç firmasını bir bütün olarak karlı hale getirmek için 10 milyarlık bir maliyeti taşıması gerekir.
Bu tür bir maliyet paylaşımı için belirli bir formül yoktur ve mantıksız görünmektedir. Bununla birlikte, modern uluslararası ilaç şirketleri için hissedar baskısıyla yüz yüze gelinmelidir. Bir ilaç şirketi para kaybettiğinde veya kârı beklentileri karşılamasa bile, hisse senedi fiyatı düşecek ve şirketin ayarlamalar yapması gerekecektir.
Aslında, modern ilaç araştırma ve geliştirmenin ortalama maliyeti, büyük uluslararası ilaç şirketlerinin kaldıramayacağı kadar yüksek hale geldi. Geçtiğimiz birkaç yıl içinde, uluslararası ilaç şirketleri Çin'in "ucuz teknoloji işçiliğini" hedeflediler ve Çin'de çok sayıda Ar-Ge kurumu kurdular. Bugünlerde, dünyanın en büyük aşı şirketi olan GlaxoSmithKline, düşük performans nedeniyle Şangay, Zhangjiang'daki Çin Ar-Ge merkezini kapattı; dünyanın en büyük insülin ilaç şirketi olan Novo Nordisk de yıllık büyüme eksikliğinden dolayı yakalandı. Danimarka medyası, yaklaşan küresel işten çıkarmaların haberini verdi ve Çin'deki ve diğer ülkelerdeki denizaşırı Ar-Ge merkezleri de bu darbeyi ilk çekenler oldu.
Bu ilaç firmalarının zayıf performansının aksine Gleevec'i üreten Novartis, son yıllarda çok güçlü bir gelişme göstermiş, sadece yeni ilaçlar geliştirmeye devam etmekle kalmamış, aynı zamanda FDA tarafından CAR-T tedavisi sağlayan ilk ilaç firması olmuştur. CAR-T tedavisinin şu anki durumu tıpkı o zamanlar Gleevec'e benziyor, ancak Gleevec'ten daha göz kamaştırıcı ve daha geniş bir beklentiye sahip. Basitçe söylemek gerekirse, CAR-T tedavisi, hastanın kendi beyaz kan hücrelerini genetik mühendisliği yoluyla değiştirmektir, böylece hastanın kendi kanser hücrelerini tanıyabilir ve onlara saldırabilir. Bu yöntem, insanoğlunun sonunda kanseri yenmesi için nihai tedavi olarak kabul edilir, bu nedenle araştırma ve geliştirme için rekabet çok şiddetli ve birçok teknik problemle karşı karşıya. Novartis'in nihai kazanan olma yeteneği şüphesiz güçlü mali desteği ile ilgilidir ve Gleevec'in satış geliri kuşkusuz bu güçlü mali desteğin önemli bir parçasıdır. Gleevec'in yüksek fiyatının, CAR-T'nin erken piyasaya sürülmesine bir dereceye kadar katkıda bulunduğu söylenebilir.

Nereye gitmeli?
"Ben tıp tanrısı değilim" unvanının kesinleşmeden önce üç kez değiştirildiği söyleniyor. "Hayır" kelimesi derin bir çaresizlik içeriyordu. Aslında "çaresizlik" uyuşturucuyla ilgili tüm bağlantıların ortak halidir. İlaçlar hayat kurtarmak için kullanılır, ancak yeni ilaçların araştırılması ve geliştirilmesi büyük yatırım gerektirir.Eğer büyük karlar olmadan sermaye çekilemezse, büyük yatırımları desteklemek imkansızdır. Büyük kâr, insanları kurtarmak için uyuşturucunun doğasına aykırı olan yüksek ilaç fiyatlarının sonucu olmalıdır. Bu kısır döngü nasıl kırılır?
Herkesin düşünebileceği bir çözüm, komşumuz Hindistan gibi doğrudan jenerik ilaçlar üretmektir. Aslında Hindistan, dünyanın en büyük jenerik ilaç ülkesidir. Sadece Çinliler değil, Amerikalılar bile ilaç alacak paraları olmadığı için Hindistan'a jenerik ilaç almaya gidecek. Böylesine büyük bir olayın nedeni, Hindistan'da jenerik ilaç üretiminin ulusal yasalarca korunmasıdır. Hindistan 1998'de DTÖ'ye katıldıktan sonra, fikri mülkiyet konularını 2005'ten itibaren ortak dünya standartlarına uygun olarak ele alma sözü verdi. Bununla birlikte, 2005 yılında Hindistan, kendi patent yasasında bazı değişiklikler yaptı ve "önceden bilinen ilaçlara" yapılan iyileştirmelerden elde edilen ilaçları, ikincisi doğa ve etkinlik açısından öncekinden önemli ölçüde farklı olmadığı sürece korumaz.
Gleevec, 2005'ten önce bilinen bir ilaç olduğundan ve Novartis, ürünlerinde önemli bir gelişme olduğunu kanıtlayamadığından, 2005 yılında Gleevec için Hindistan patenti için başvurduklarında Hindistan Patent Ofisi tarafından reddedildi. O zamandan beri Novartis, Hindistan'da Gleevec çevresinde bir patent davası başlattı ve kaybetmeye ve itiraz etmeye devam etti. Yedi yıllık bir maraton duruşmasının ardından, Hindistan Yüksek Mahkemesi 2013'te Novartis'in davayı kaybettiğine karar vererek Patent Ofisinin red kararını ve alt mahkemenin önceki kararını onayladı. Açıktır ki, Shenyou Ülkesi gibi tüm ülkeler patentleri "koruyamaz".
Bilimsel araştırma kurumlarının ilaç geliştirmesine neden izin vermiyorsunuz diye sorabilirsiniz. Aslında birçok ilacın ön araştırma ve geliştirme çalışmaları, ilaca dönüşmesi beklenen belirli bir kurşun bileşiği bulunana kadar bilimsel araştırma kurumları tarafından tamamlanmaktadır. İşin bu kısmı ilaç geliştirmede neredeyse sıfır maliyetlidir veya maliyetin sadece küçük bir kısmını oluşturur.
Gerçek zorluk, öncü bileşiğin sonraki modifikasyonunun yanı sıra hayvan ve klinik deneylerde yatmaktadır. Genel bilimsel araştırma kurumları, bu görevleri tamamlayacak insan gücüne veya mali kaynaklara sahip değildir ve genellikle bu görevlerin bazıları için gerekli özel niteliklere sahip değildir. Bu nedenle, en maliyetli işin bu kısmı sadece ilaç firmaları tarafından yapılabilir ve kaçınılmaz olarak ilaçların maliyetinin bir parçası haline gelecektir.
Herhangi bir yol var mı? Önceki basit aritmetik probleme de dönüp bakabiliriz. Bir ilaç firmasının ilacı alması 10 milyar aldı.Yüksek maliyetin çoğu ilaç geliştirmedeki belirsizlik riskidir. Bu risklerden kaçınılabilirse, ilaçların maliyeti doğal olarak düşecektir.
Aslında günümüzün uluslararası ilaç firmaları gerçekten de bunu yapıyorlar ve önceki "Ar-Ge, Ar-Ge ve Ar-Ge" modelini "Al, Al, Al" olarak değiştirdiler. Nedeni basit: 99 başarısız projeyi desteklemek için 10 milyar harcamak yerine, ilk başarıya ulaşmış beş küçük ilaç geliştirme şirketini satın almak için 5 milyar harcamak daha iyidir.Her küçük şirket hücre testini geçen ve hatta geçen iki veya üç şirketi getirebilir. Hayvan testleri için bir ilaç araştırma ve geliştirme projesi. Böyle bir projenin başarıya ulaşması çok daha olasıdır ve sonunda birden fazla kişinin pazarlanan bir ilaç haline gelmesi muhtemeldir. Bu şekilde her ilacın ortalama maliyeti 10 milyardan çok daha azdır.
Bununla birlikte, ilaç araştırma ve geliştirme her şeyden önce riskli, bu yeni model altında yok mu? Aslında durum bu değil. Risk hala var, ancak yukarıdaki aritmetik problemde görünmeyen 5 hatta 50 küçük ilaç geliştirme şirketi tarafından üstleniliyor. Ve araştırma ve geliştirme maliyetleri risk sermayesinden, hatta A turu ve B turu yatırımından geliyor, ancak son "alıcıyı" bulamadılar. Bu şekilde, büyük ilaç şirketlerinin yalnızca satın alınması gereken küçük ilaç Ar-Ge şirketlerini dikkatlice taraması veya projelerini doğrudan satın alması ve ardından başarı oranını büyük ölçüde artırabilecek ve listelenen ilaçların payını azaltabilecek nihai klinik araştırma yatırımını takip etmesi gerekir. Maliyet gerçekten ilaçların fiyatının düşmesine izin veriyor.
Son yıllarda uluslararası ilaç firmalarının küçük ilaç Ar-Ge firmalarının birleşmesi ve satın alması haberleri duyulmaktadır. Özellikle, yükselişteki antikor ilaçlarının çoğu, küçük şirketler temel geliştirmeyi tamamladıktan sonra büyük şirketlere satılır. Amerika Birleşik Devletleri ve Avrupa'daki bilimsel araştırma kurumlarında, bilim adamlarının küçük ilaç araştırma ve geliştirme şirketlerinin kaynağı haline gelen şirketler kurmaları için de bir artış oldu. Sonunda, eksiksiz bir zincir oluşturuldu: bilimsel araştırma kurumları kapsamlı ilgi odaklı temel araştırmalar yapıyor; küçük ilaç şirketleri, hedefe yönelik öncü bileşik odaklı ilaç öncesi araştırma ve geliştirme yapıyor; büyük ilaç şirketleri, ilaca yönelik geç aşama klinik araştırma yapıyor. Bu zincirde bilimsel araştırma kurumlarının risk alma problemi yoktur; küçük ilaç geliştirme şirketlerinin riskleri olmasına rağmen, nihayetinde ilaç kullanan hastalara aktarılmayacaktır; büyük ilaç firmaları riskleri etkin bir şekilde kontrol edebilir, ilaç maliyetlerini düşürebilir ve hastalara fayda sağlayabilir. .
Ne yazık ki ülkemizde böyle bir zincir oluşturulmaktan çok uzak. Bir yandan, bilimsel araştırmacıların şirket kurma istekliliği güçlü değil ve politika desteği yetersiz; öte yandan, yerli risk sermayesi hayali yeni kavramların peşine düşme konusunda daha hevesli ve ilaç araştırma ve geliştirmeye yatırım yapmaktan korkuyor. Büyük ilaç firmaları için sermaye birikimi yeterli olmaktan uzaktır, sadece bağımsız ilaç araştırma ve geliştirme çalışmalarını yürütmek değil, aynı zamanda küçük ilaç şirketlerinin satın alınmasını sağlamak da zordur.
Elbette, riski nasıl paylaşırsak paylaşalım, sadece maliyet tarafı sorununu çözebiliriz. Ve maliyet hiçbir zaman fiyatın tek belirleyicisi, hatta ana belirleyicisi değildir. Fiyatlar daha çok piyasa arz ve talebine göre belirlenir. Açıkça söylemek gerekirse, serbest bir pazarda, birisi bu fiyatı ödemeye istekli olduğu sürece, bu ürün bu fiyata değer. Bu, Gleevec gibi hayat kurtaran ilaçlar için geçerlidir.
İyi giden eski bir söz vardır: "Para kazanmak istiyorsan, soygunun yanında ilaç da satmalısın." "Ben tıp tanrısı değilim" de Xu Zheng, iki "işletme" arasındaki ortaklığı ifade etmek için dört kelime bile kullanıyor - - "Hayat paradır!" Karar tamamen piyasada ise, Gleevec gibi ilaçların kaçınılmaz olarak daha pahalı hale geleceğini hayal etmek zor değil. Bunun maliyetiyle hiçbir ilgisi yok. Bu nedenle, yalnızca devlet denetimi ve rehberliği yoluyla ilaçların fiyatlandırması rasyonaliteye dönebilir.
Sonuna yaz
Yapısal biyoloji alanına geçtiğimde beni cezbeden şey, proteinlerdeki binlerce atomun uzamsal koordinatlarını çözme zorluğuydu. Bu alana derinlemesine indikten sonra, onunla ilaç araştırma ve geliştirme arasındaki derin bağı anladım ve bu disiplinden daha da büyülendim.
Her yapısal biyoloğun kalbinde yeni ilaçlar geliştirme hayali olduğu söylenmelidir. Tabii ki, çoğumuzun da bununla hayatımızı iyileştirmeyi umduğumuza inanıyorum (yurtiçi ve yurtdışındaki bilimsel araştırmacıların tedavisi konusu da şikayet edemez), ama daha da önemlisi BrianDruker gibi bir ilaç kullanabilirsek Belli bir hastalığın tüm hastalarının yaşam koşullarını değiştirmek, hatta hayat kurtarmak, dünyadaki hiçbir şeyin kıyaslayamayacağı bir şans ve mutluluk olacaktır.
Tıp kralı Sun Simiao bir zamanlar "Bin Altın Temel Reçeteler" e şöyle yazmıştı: "Yardım isteme ihtiyacı varsa, zengin mi yoksa fakir mi, yaşlılar, kızgın akrabalar ve arkadaşlar, Huayi, aptal, evrensel vb. Akraba gibidir. "Hipokrat Yemini'nin Çin versiyonu olarak kabul edilebilir." Günümüzde hastalar temelde tıbbi teşhis ve tedavi alabiliyor ama tıp hala tam olarak çözülemeyen bir sorun ... Bu yüzden "Ben tıp tanrısı değilim" gibi gözyaşları dökücü hikayeler var.
Yaşam bilimleri alanında bir araştırmacı olarak, umarım hayatımda tüm hastaların ilacı alabilmesi için dünyaya bir ilaca katkıda bulunma fırsatı bulabilirim. Bu kanıtı saklayın ve asıl niyetinizi unutmayın!