Önleyici aşı endüstrisi ayrıntılı raporu 1: Politikalar
(Hatırlatma: Bu makale dört rapor serisinden biridir. Bu rapora ve diğer üç rapora ihtiyacınız varsa, lütfen arama yapmak ve indirmek için gelecekteki düşünce kuruluşu www.vzkoo.com'da oturum açın)
Önümüzdeki on yıl içinde Çin'in aşı endüstrisi konusunda iyimseriz.Yatırım stratejisi, satın almak ve uzun süre bekletmek için nispeten uygun olmalıdır.
En iyi aşı üreticilerinin üç standardı olduğuna inanıyoruz: ağır çeşitler + teknoloji birikimi + kalite kontrol kültürü. Standart, çeşitliliğe kısa vadede, yani çeşitliliğin potansiyel büyümesine ve çeşitliliğin rekabet gücüne, uzun vadede teknoloji ve teknoloji birikimine bakmak için parçalara ayrılmıştır. Teknolojiye ve süreç birikimine uzun vadeli odaklanmanın nedenleri şunlardır:
Aşıların sanayileşmesi, uzun vadeli deneyim birikimini gerektirir. ABD aşı pazarındaki yüzlerce yıllık gelişmeden sonra, 28'inci-sekizinci model çok açıktır Geri kalan devlerin tümü zengin sanayileşme tecrübesine sahip şirketlerdir. Aşılar, diğer biyolojik ilaçlardan farklıdır. Etkili hedeflerin ve sinyal yollarının taranması, aşı endüstrisi için tam olarak uygulanamaz. Antikor ilaçların moleküler boyutu 5-10 nm iken, aşıların antijen boyutu 30-100 nm'dir ve bu daha sonra alüminyum adjuvan tarafından adsorbe edilir. Boyut 5000-20000 nm'ye ulaşır Molekül büyüdükçe aşı antijen bileşiminin stabilitesi monoklonal antikorlarınkinden daha düşüktür, bu nedenle aşıların üretimi ve kalite kontrolü için gereklilikler daha yüksek olacaktır. Aşı kitlesinin özelliği ve geniş kitlesi onun özel sosyal önemini belirler.Yeni bir antijeni keşfetmek, değer yaratmanın yalnızca ilk adımıdır.Diğer bir çekirdek rekabet gücü ise süreç rotası, yani antijeni güvenli, etkili ve etkili bir şekilde nasıl hazırlayacağınızdır. Ticari aşılar. Bu nedenle, ürün güvenliği ve bağışıklık etkisinin garantisi, büyük ölçekli üretim süreci yollarının araştırılması, süreçlerin olgunluğu ve kararlılığı ve üretim sürecinin kalite kontrolü, viroloji, immünoloji ve üretim süreçleri etrafındaki uzun vadeli birikimin sonucudur.
Sanayileşme deneyimine ek olarak, teknolojinin ve sürecin uzun vadeli birikmiş değeri, yenilik yapma ve aşma yeteneğinde yatmaktadır.Aşı geliştirme tarihi boyunca, büyük çeşitlerin doğuşu uzun vadeli teknoloji birikimine sahip şirketlerden gelmektedir.
Daha sonra, Pfizer'in satın alınması yoluyla pnömokokal konjuge aşının (PCV) anlamını ve GSK'nın tetravalan menenjit aşısının (MCV4) neden yükselen bir yıldız haline geldiğini öğreneceğiz. Gösterilecek iki örnek: gişe rekorları kıran çeşitlerin aşı şirketleri için değeri ve bağışıklık etkisi aşıdır Çeşitlerin temel rekabet gücü ve mükemmel çeşitlerin doğuşu tesadüfi değil, uzun vadeli teknoloji birikimi ve mirasın sonucudur.
Örnek 1: Wyeth'in satın alınması ve bir pnömokok konjuge aşının edinilmesi, Pfizer'ı aşı endüstrisinin liderlerinden biri haline getiriyor
Pfizer, 1849'da kuruldu. İlk günlerinde, Pfizer esas olarak ilaç alanında faaliyet gösteriyordu.II.Dünya Savaşı sırasında sitrik asit ve penisilin tedariki, Pfizer'in büyük bir servet biriktirmesine yardımcı oldu. 1963 yılında Pfizer, inaktive edilmiş aşı Pfizer-Vax Kızamık-K'yi üretmek için John Enders tarafından geliştirilen Edmonton B tipi kızamık suşunu kullandı. Aşılanan popülasyondaki aşının ters reaksiyonu Merck'in canlı zayıflatılmış aşısı Rubeovax'ınkinden daha az olmasına rağmen, Aşılanan çocukların çoğunda bir yıl sonra saptanabilir kızamık antikorları yoktu, bu nedenle aşı 1968'de piyasadan çekildi. 1965 yılında Pfizer tarafından pazarlanan kızamık zayıflatılmış bir aşı olan Pfizer-Vax Kızamık-L, 1975 yılında Merck'in Attenuvax canlı zayıflatılmış aşısı ile değiştirildi. Aşılardaki sürekli başarısız girişimler, Pfizer'ı aşılarda uzun vadeli zayıf bir pazar payı haline getirmiştir. 2009'da Wyeth'in satın alınmasına kadar Preyer'in 7 değerli konjuge pnömokok aşısını elde etmek, endüstri liderlerinden biri haline gelmeden önce değildi. 2014 ve 2015'te, B, C ve ACWY menenjit aşıları, satın almalar ve bağımsız araştırma ve geliştirme yoluyla piyasaya sürüldü. Bununla birlikte, Pfizer'in menenjiti ve diğer aşıları GSK ile rekabet edemiyor ve mevcut aşı işi geliri hala nispeten bekar.
Şirketin mali verilerine bakıldığında, Pfizer'in aşı işi geliri 2010'dan 2018'e kadar sürekli bir yükseliş eğilimi gösterdi ve toplam gelirdeki payı her yıl arttı. 2018'de% 12'yi aştı. Aşı işi, Pfizer'ın tüm işletmelerinde kademeli olarak arttı. Konum o kadar önemli.
2018'de şirketin toplam gelirinin% 12'si aşı işinden geldi. Temel aşı kategorisi Preliminary serilerdi (esas olarak PCV13), TicoVac yalnızca% 3'ünü oluşturdu ve kalan% 5'i ise çoğunlukla ACWY IV'ten geldi. Menenjit aşısı ve B menenjit aşısı. PCV13 (Preliminary 13 olarak da bilinir) 2010'daki lansmanından sonra iyi bir performans gösterdi. Başlangıçta 6 haftadan 5 yaşına kadar olan bebeklerde ve yeni yürümeye başlayan çocuklarda kullanım için onaylandı.Uygulanabilir yaş grubunun genişlemesi, PCV13'ün gelir artışının ana itici gücüdür. 2011 yılında, 50 yaş ve üstü yetişkinlerde kullanım için onaylandı; Haziran 2012'de, Amerikan CDC'nin Bağışıklama Danışma Komitesi (ACIP), 19 yaş ve üstü bağışıklık yetmezliği olan yetişkinlerde kullanılmak üzere PCV13'ü tavsiye etti; 2013'te 6-17 yaş arası çocuklarda ve çocuklarda kullanım için onaylandı. Ergenler; 2014 yılında, ACIP komitesi, pnömokok enfeksiyonunu önlemek için 65 yaş ve üstü yetişkinler için rutin bir aşı olarak PCV13'ü bir kez daha önerdi; Temmuz 2016'da 18-49 yaş arası yetişkinler için onaylanan PCV13, tam yaş kapsamına ulaştı, böylece teşvik etti PCV13 ve Preyer serileri sürekli bir büyüme parkuruna girmiştir (2016-2017'de devlet ihale projelerinde kısa vadeli değişiklikler Preyer serisinin gelirlerinde düşüşe neden olmuştur). Pazar satış verileri açısından bakıldığında, her yaşta daha iyi bağışıklık koruma etkilerine sahip olan Prey serisi, Merckin PPV23 ve GSKnın PCV10unun çok ilerisindedir.


Pfizer'in aşı işinin temel teknolojisi, Wyeth'in mirasından geliyor ve Wyeth, bir asırdır derin bir makromoleküler araştırma birikimine sahip.
Pfizer'in aşı pazarındaki başarısı, aslında Preliminary serisinin başarısıdır ve özünde Wyeth'in uzun vadeli birikiminin sonucudur. Pfizer'in Wyeth'i satın almasının ardından, Ar-Ge ekibi iki gruba ayrıldı: Makromolekül ve aşı işi, eski Wyeth kıdemli başkan yardımcısı Mikael Dolsten ve Bioinnovation Center ekibi tarafından yönetildi. Pfizer'in eski küresel Ar-Ge direktörü Martin Mackay, küçük moleküllere odaklanan Pharma yan kuruluşuna liderlik etti. 2009 yılında tüberküloz aşısı kar amacı gütmeyen kuruluş Aeras'a katılmak için istifa eden Wyeth'in aşı işinin eski genel müdürü ve başkan yardımcısı Jim Connolly dışında, eski Wyeth aşı araştırma ve geliştirme ekibinin çoğu Pfizer'in aşı departmanına katıldı.
Pfizer'in aşı teknolojisi ve Ar-Ge ekibinin esas olarak Wyeth'den miras kaldığı söylenebilir.Wyeth'in en eski aşı üretim kaydı 1941'e kadar izlenebilir. Yaklaşık 80 yıllık geliştirme sürecinde Wyeth, satın almalar, işbirliği ve kendi kendine araştırma yoluyla teknolojik birikimi tamamladı. 1862'de John ve Frank Wyeth, Wyeth'in selefi olan küçük bir laboratuvar ile bir eczane açtılar; 1872'de Wyeth tablet presini icat etti ve ilaçların seri üretimine başladı; 1943'te Wyeth, Gilland Laboratuvarı'nı ve diğer altı deneyi satın aldı. Laboratuarda, Gilland laboratuvarının öncülü, çiçek aşısı öncüsü Hamill Alexander tarafından 1882'de kurulan Lancaster aşı çiftliğiydi.Arındırılmış çiçek aşısı, hastalardan elde edilen variola virüsü ile ineklerin aşılanması ve hastalıklı numunelerin toplanmasıyla elde edildi. Satın alma, çiçek hastalığı aşısı, tetanoz aşısı ve tifo aşısı ve bunların teknolojilerini, Wyeth'in daha sonraki tam hücre DPT aşısı geliştirmesinin temeli olan Wyeth'e getiriyor.
Wyeth'in kombine aşı teknolojisinin kaynağı, 1994 yılında Laidley Laboratories'in (Praxis, American Cyanamid) satın alınmasıdır. Lederle Laboratories, başlangıçta American Cyanamid'e bağlıydı ve 1994 yılında Cyanamid ile birlikte Wyeth tarafından satın alındı, Lederle'nin deneysel polisakkarit protein bağlama teknolojisi ise 1988'de satın alınan Praxis'ten geldi. Ledley, aşı üretimini, araştırma ve geliştirmeyi entegre eden ağır bir laboratuvardır. Satın alma tarihinden itibaren, çeşitli aşılara ve 23 valanslı pnömoni polisakkarit aşısı, grip aşısı ve aselüler DPT aşısı dahil olmak üzere kombine aşı teknolojilerine sahiptir. Amerika Birleşik Devletleri 1902 yılında üretim lisansı sistemini uygulamaya başladıktan sonra, Ledley Laboratories, üretim lisanslarını alan ve Amerikan üretim lisans sistemi altında ilk difteri aşısını pazarlayan birkaç laboratuvardan biriydi. 1983 yılında, Ledley Laboratuvarı'ndan 23 valanslı pnömokok polisakkarit aşısı Pnu-Imune 23 pazarlama için onaylandı, ancak Pnu-Imune 23, bebeklerde ve 50 yaşın üzerindeki yaşlılarda zayıf bir etkinliğe sahipti (polisakkarit aşısının özellikleriyle bağlantılı olarak). Wyeth, 1994 yılında Ledley Laboratories'i satın aldıktan sonra polisakkarit-protein bağlama teknolojisini satın aldı ve ardından polisakkarit aşılarını bıraktı ve pnömokok konjuge aşı geliştirmeye geçti ve 2000 yılında 7-valentli pnömokok konjuge aşı Prevenar 7'yi piyasaya sürdü.
Örnek 2: GSK tetravalan menenjit aşısı Sanofi'den daha üstündür ve teknoloji yükseltmesi Novartis'ten satın alınan Chiron'dan gelmektedir.
Birçok menenjit aşısı türü vardır. ABD pazarında tek değerlikli, iki değerlikli ve dört değerlikli menenjit aşıları vardır. En eski menenjit aşısı, Merck tarafından üretilen C menenjit polisakkarit aşısıdır. O zamandan beri A ve AC türleri ortaya çıkmıştır. Menenjit polisakkarit aşısı, ACWY quadrivalent konjuge menenjit aşısı ve monovalent aşı yavaş yavaş değiştirilmektedir.
Konjuge aşı, bağışıklığı düşük kişilerde daha iyi bir bağışıklık etkisine sahip olduğu için, ABD pazarı esas olarak Menveo (GSK) ve Menactra (Sanofi, SP) arasındaki rekabettir. Teknik açıdan Menveo (GSK), difteri toksoid (DT) kullanan Menactra'dan (SP) daha iyi bağışıklık etkilerine sahip olan CRM197 taşıyıcı protein kullanır. GSK'dan Menveo, 2014'te Novartis'in yerine geçen bir varlıktan geldi. O sırada Novartis, GSK'nın kanser ilacı varlıklarını satın almak için 16 milyar ABD doları harcadı. Aynı zamanda, Novartis, 7,1 milyar ABD doları için patentlerle (esas olarak Chiron, ancak grip aşısı işi değil) aşı işine değer verdi. GSK'ya satıldı.Bu değişimde GSK, B menenjit aşısı olan Bexsero'yu da aldı ve daha da önemlisi, aşı hazırlamak için ters aşılama kullanan dünyadaki ilk şirket olan Chiron ile birleşti. Daha sonra GSK, kendi geliştirdiği dört değerlikli menenjit konjugat aşısı Nimenrix (TT taşıyıcı protein) ve dört değerlikli menenjit polisakkarit aşısı Mencevax'ı 2015 yılında Pfizer'a sattı.
Taşıyıcı proteindeki farklılığa bağlı olarak Menveo (GSK), Menactra'dan (SP) daha fazla adolesan ve yetişkinde yüksek düzeyde antikor üretimini indükleyebilir. Peter M. Dull ve arkadaşları, Menveo (GSK) ve Menactra'yı (SP) karşılaştırdı. 11-18 yaşlarındaki toplam 2.180 ergen, iki aşı ile rastgele aşılandı Serum antikor titreleri (hSBA), aşılamadan bir ay sonra analiz edildi. ) Seviye. Sonuçlar, daha yüksek antikor titrelerine sahip kişilerin, Menveo (GSK) ile aşılanan insanların daha büyük bir oranından sorumlu olduğunu gösterdi. 2007 yılında, 1359 aşılanmamış kişiyi (19-55 yaş) içeren bir denemede Menveo (GSK) ve Menactra (SP) aşılarının uygulanmasından bir ay sonra, deneklerdeki dört serotipin antikor titreleri önemli ölçüde artmıştır. . Menveo (GSK), A tipi meningokoklara karşı bağışıklık açısından Menactra'dan (SP) daha düşük değildir ve C, W135 ve Y tipi meningokoklara karşı daha iyi bağışıklığa sahiptir. 2014 yılında, Amerikan Aşılama Danışma Komitesi (ACIP), Menveo'nun (GSK) önerilen yaşını 9 aydan 55 yaşa, 2 aydan 55 yaşa çıkardı ve Menveo (GSK) gelirinin hızlı büyümesine yol açtı. Bundan, GSK tetravalan menenjit aşısının, yüksek satış büyümesini sağlayan daha iyi bir aşılama etkisine sahip olduğu ve temel teknolojisinin tanınmış Chiron şirketinden miras alındığı görülebilir.


Politika makaleleri
100 yıllık ABD aşı endüstrisi iki büyük dönüş yaşadı ve yasal güncellemeler endüstri eşiklerini ve pazar konsantrasyonunu artırdı
Aşı teknolojisinin özellikleri ve piyasa, baş etkisinin çok açık olduğunu belirlediğinden, ABD aşı endüstrisinin tipik bir "28 ilkesi" vardır. 1901'de Amerika Birleşik Devletleri'nde 8 aşı üreticisi vardı. 2018'de 17 şirket vardı. 117 yılda 31 aşı şirketi çekildi. Bunlardan 23 şirket, birleşme ve satın almalar nedeniyle (kazalar nedeniyle satın alınan şirketler dahil) kaybolurken, diğer 8 şirket olumsuz sektör olaylarının etkisiyle tamamen geri çekildi.Sanayi yoğunlaşmasındaki artışın önemli nedenlerinden biri endüstriyel entegrasyon haline geldi.
Endüstriyel entegrasyonun arkasında aslında düzenleyici iyileştirmelerin teşviki var.Çok sayıda kazanın ortaya çıkması nedeniyle, ABD aşı endüstrisi 1902, 1944 ve 1986'da üç büyük yasa çıkardı ve endüstri üzerinde derin bir etki yaptı. Geçtiğimiz yüzyılda, ABD aşı endüstrisi, aşı üreticilerinin sayısında önemli bir düşüşle sonuçlanan iki "dönüş ve dönüş" döneminden geçti: 20. yüzyılın başlarında, 1970'ler ve 1980'lerde. İşletmelerin ikinci kez çekilme sebebi ise "hatasız sorumluluk sistemi" nin belirlenmesi nedeniyle yasal işlemlerin artması oldu ve birçok işletme tazminat ödeyemedikleri için çekildi. ABD aşı endüstrisinin gelişim tarihinden farklı olarak, Çin'in aşı endüstrisinin yoğunlaşmasındaki artışın, daha çok idari gücün (esas olarak onay sistemi) teşvikine bağlı olacağına inanıyoruz.
Aşıların ve diğer biyolojik ürünlerin üretim sürecinin kontrol edilemeyen doğası nedeniyle, üretim sürecinin kararlılığı ve güvenliği endüstrinin en temel ve önemli gereksinimleri haline gelmiştir. Olumsuz olayların ortaya çıkması, ABD aşı endüstrisinin özellikle üretim için düzenleyici düzenlemelerinin iyileştirilmesine ve yükseltilmesine neden olmuştur. Yarı bitmiş ürünlerin ve bitmiş ürünlerin proses güvenliği, saflığı ve gücü için standartların oluşturulması ve test yöntemlerinin standardizasyonu için gereklilikler. 20. yüzyılın başından itibaren, aşı üretimi, satışı, çeşit kaydı, dolaşım ve pazarlama sonrası izleme ile ilgili yasa ve yönetmeliklerin kademeli olarak getirilmesi ve kurumların kurulması, ABD aşı güvenliği yönetim sisteminin çerçevesini oluşturdu.
Amerikan aşı endüstrisindeki sorunların esas olarak şunlara odaklandığını hatırlatarak: aşı suşlarıyla ilgili sorunlar (atalara dönüş); inaktivasyon gibi süreçlerdeki kusurlar; adjuvanların doğasının yetersiz anlaşılması; hammadde ve yardımcı maddelerin güvenliğiyle ilgili sorunlar; aşı katkı maddeleri ile aşıların yapısındaki değişiklikler Yetersiz biliş; pazar sonrası değerlendirme ve talep mekanizmasının kurulması vb.
Aşı suşunun stabilitesiyle ilgili sorunlar (eski haline dönme): 1986'da, Amerika Birleşik Devletleri'nin Kansas bölgesindeki bir bebek, Cyanamid tarafından üretilen oral canlı zayıflatılmış çocuk felci aşısı (OPV aşısı) Orimune ile aşılandıktan sonra çocuk felci ile enfekte oldu. Çalışmalar, OPV aşısının belirli kusurları olduğunu bulmuştur Zayıflatılmış çocuk felci virüsü, bazı bağışıklık yetersizliği olan kişilerde ve dış ortamda genetik mutasyonlara sahip olabilir ve yüksek derecede patojenik çocuk felcinden türetilmiş bir virüse geri dönebilir. Amerikan Cyanamid şirketi, 10 milyon ABD doları tazmin etti ve 1994'te satın alındı.
İnaktivasyon sürecindeki kusurlar: 1955 yılında Amerika Birleşik Devletleri'nde çok ciddi inaktive edilmiş çocuk felci aşısı kazası meydana geldi. California, Berkeley'de Cutter Laboratory tarafından hazırlanan iki grup çocuk felci aşısı ile toplam 120.000 çocuğa aşı yapıldı ve sonuç olarak 60 çocuk aşılandı. Çocuk felci meydana geldi. Kazanın nedeni, virüsün formalin ile tam olarak etkisiz hale getirilmesi ve uygun olmayan aşı güvenliği inceleme yöntemlerinin kullanılmasından kaynaklanıyordu. Aşıların kontrolünü güçlendirmek için ABD hükümeti, ilgili hükümet düzenlemelerini uygulamak için özel bir Biyolojik Ürünler Standartları Bürosu kurdu.
Adjuvan özelliklerinin yetersiz anlaşılması: 1959'da Parker Davis'in tam hücre DPT'si ve çocuk felci aşısı Quadrigen, pazarlama için onaylandı ve bu aşıda yeni bir adjuvan benzetonyum klorür kullanıldı. Aşı, pazarlandıktan sonra bir dizi yan etkiye neden oldu, bebeklerden biri aşı nedeniyle felç oldu ve kalıcı olarak zihinsel olarak hasar gördü. Çalışmalar, sıcaklık değiştiğinde, benzetonyum klorürün, Clostridium tetani'nin hücre duvarına zıt yüklerle bağlanarak adjuvan inaktivasyonuna ve hücre duvarının yırtılmasına neden olarak aşının etkinliğini azalttığını ve toksisiteyi artırdığını bulmuştur. 1968'de Parker Davis, yardımcı maddenin niteliğine ilişkin yetersiz araştırma ve denetim süreci sırasında uygunsuz işlemden dolayı 650.000 ABD doları para cezasına çarptırıldı. Ardından Parker Davis ilgili ürünü geri çekti. Bu olay sonunda Parker Davis'in 1970'te aşıdan çekilmesine yol açtı. Market.
Hammaddelerin kalite denetimi yapılmamış 1. 19. yüzyılın sonunda, Amerika Birleşik Devletleri difteri aşısı hazırlamak için difteri basili ile aşılanmış at serumu kullandı. 1901'de Amerika Birleşik Devletleri, St. Louis'de bir difteri aşısı kontaminasyonu olayı çocuklarda 13 ölüme neden oldu. Kazanın nedeni, aşı hazırlama laboratuvarının test edilmemesi ve tetanoz kullanmasıydı. Clostridium kontamine serum. Aynı yıl ABD'de New Jersey'de de benzer nedenlerle bir çiçek aşısı Clostridium tetani ile kontamine olmuş ve 9 çocuğun ölümüyle sonuçlanmıştır. Bu iki olay Amerika Birleşik Devletleri'ni 1902'de ilk olarak aşı ürünlerinin saflığını ve etkinliğini gerektiren "Biyolojik Ürünler Kontrol Yasası" nı yayımlamaya itti. 2. 1942'de, II.Dünya Savaşı sırasında Amerikalı savaşçılar, sarı hummaya karşı aşılandı ve ayrıca dirençlerini artırmak için insan bağışıklık serumu enjekte edildi.Sonuç olarak, yaklaşık 25 milyon aşılayıcıdan 28.600'ü sarılık hepatiti geliştirdi. 62 tanesi öldü. Araştırma, bazı insan bağışıklık serum serilerinin hepatit virüsü ile kontamine olduğunu buldu. Bu kirlilik olayının meydana gelmesi, biyolojik ürünlerin üretim sürecinin kalite kontrolünü ve pazarlamadan önce ürünlerin saflığını harekete geçirdi. 1944'te ABD Kongresi 1902 düzenlemelerini tamamladı ve aşılar gibi biyolojik ürünlerin güvenliğini, saflığını ve etkililiğini sıkı bir şekilde düzenledi. Değerliğin tanımı ve standart ölçüm yöntemleri.
Aşı katkı maddeleri, aşıların doğasındaki değişikliklerden yeterince haberdar değildir: Thiomersal,% 49.6 etil cıva içeren organik bir bileşiktir.Eli Lilly, 1929'da timerosal geliştirdi ve ticari kullanım için kaydettirdi. Aşılarda en yaygın kullanılan koruyuculardan biri olan timerosal ve otizm arasındaki ilişki uzun zamandır tartışma konusu olmuştur. Bir timerosal geliştiricisi olarak Eli Lilly, yüzlerce hukuk davası ile karşı karşıya kaldı ve aşı yaralanması tazminat programı kapsamına giremedi, bu da Eli Lilly'nin 1980'lerde timerosal içeren ürünlerin üretimini durdurmasına ve sonunda 1988'de aşı pazarından çekilmesine yol açtı. 1999 yılında, CDC ve FDA ayrıca üreticilerin timerosali çocukluk aşılarından çıkarmalarını istedi.
Pazarlama sonrası değerlendirme, aşı kalite kontrol ve denetiminin önemli bir parçasıdır: 1. 1976'da Amerika Birleşik Devletleri'nde iki ciddi influenza virüsü enfeksiyonu vakası meydana geldi ve hastalardan domuz gribi virüsleri izole edildi.Serolojik çalışmalar virüsün antijenitesini ve 1918 influenza pandemisini buldu Virüsün virüs serotipleri aynıydı, bu nedenle pazarlanması için acilen onaylandılar ve ülke çapında domuz gribi aşısının aşılanması için acil önlemler alındı. Yaklaşık 45 milyon doz aşı aşılandı. Testler, yeni aşılanan popülasyonda Guillain-Bahreyn sendromlu hastaların ortaya çıktığını buldu. Araştırmalar, domuz gribi aşısı sonrası Guillain-Bahreyn sendromu görülme sıklığının normal insidansdan 3.96-7.75 kat daha fazla olduğunu kanıtladı. 2. Rotavirüs aşısı Rotashield ve Lyme hastalığı aşısı LYMERix'in piyasaya sürülmesi ve kaldırılması, aşının pazar sonrası değerlendirmesinin önemini de yansıtmaktadır. 1998'de, Wyeth Laboratories'in tetravalan canlı zayıflatılmış rotavirüs aşısı Rotashield FDA tarafından onaylandı.Sonra, o yılın Eylül ayından ertesi yılın Ekim ayına kadar, ABD Aşı Olumsuz Olay Raporlama Sistemi VAERS, Rotashield ile ilgili toplam 101 teyit edilmiş vaka aldı. Wyeth, varsayılan intussusepsiyon vakalarına ek olarak, 1999'un sonunda aşıyı piyasadan çekeceğini duyurdu. 1998'de FDA, Smith Kane tarafından üretilen Lyme hastalığı aşısı LYMERix'i onayladı. Lyme hastalığı, Borrelia burgdorferi bakterisinin neden olduğu kene kaynaklı bir hastalıktır.Etkili tedaviler bulunmasına rağmen, Lyme hastalığının önlenmesi hala en iyi seçimdir. İzin aldıktan sonraki bir yıl içinde, LYMERix yaklaşık 66 aşılayıcıda ciddi artrite neden oldu. Çalışmalar, insan lökosit ile ilişkili antijen genotiplerine sahip kişilerde, LYMERix'in bu genetik olarak duyarlı bireylerde otoimmüniteye neden olabileceğini bulmuştur. Son olarak, Smith Kane ürünü 2002'de geri çekti.
Sağlam bir iddia mekanizması, endüstrinin sağlıklı gelişimini garanti ediyor: 1970 ve 1986 yılları arasında, aşı üreticilerine karşı açılan davaların sayısındaki artış nedeniyle, bazı aşı şirketleri ürün çeşitlerini azalttı ve bu da piyasadaki aşı türlerinde keskin bir düşüşe neden oldu. ABD Kongresi 1986'da Ulusal Çocuk Aşı Yaralanması Yasasını kabul etti, Olumsuz Aşı Reaksiyonu İzleme Sistemini (VAERS) kurdu ve yardım fonunun kaynağı olarak her aşının satışından 0,75 ABD doları vergi ödedi ve alıcılar ulusal düzeyde tedavi edildi. Aşıdan etkilenen bireyler tazmin edilecektir. 1988 yılında, bu temelde, aşı hasarı tazminatı için başvuru prosedürlerini büyük ölçüde basitleştiren "Aşı Yaralanması Tazminat Prosedürü" kabul edildi. İlgili yasa tasarısı ve tazminat planının oluşturulmasının ardından, aşı üreticilerinin sayısında açılan davalardan kaynaklanan düşüş, izleyen on yıl içinde hafifledi.
ABD'de Aşı Endüstrisindeki Kazalar Üzerine Araştırma - Nedenlerini ve Sektör Etkisini Gözlemlemek İçin Carter Laboratuvarı Olayından
Amerika Birleşik Devletleri'nde aşı tarihindeki en önemli kazalardan biri şüphesiz Nisan 1955'in sonunda Carter Laboratuvarlarında Salk ile inaktive edilmiş çocuk felci aşısı olayıydı (Salk aşısı üç omurilikten oluşur: Mahoney, MEF-1 ve Saukett). Poliovirüs suşu, Vero hücrelerinde kültürlendi ve daha sonra bir aşı yapmak için formalin ile inaktive edildi. Aşı, ilk olarak Amerika Birleşik Devletleri'nde Haziran 1954'te büyük ölçekli randomize kontrollü çift kör bir deneyde gerçekleştirildi ve Nisan 1955'in başlarında onaylandı. Güvenli ve etkili koruma oranı% 85 -% 90'a ulaşır). Nisan 1955'te, laboratuar tarafından üretilen ilk sekiz enjeksiyon serisindeki iki grup virüs tamamen inaktive edilmedi ve 200 kişinin kalıcı felç ve 10 ölümle sonuçlandı, bunun için Carter Laboratuvarı'na dava açıldı. İnceleme ve analiz, kazanın temel sebebinin Carter Laboratuvarlarının standart dışı çalışması, sıkı kalite kontrol bağlantılarının olmaması ve ABD düzenleyici kurumların ihmali olduğunu gösteriyor.
Teorik bir perspektiften, canlı virüslerin kitlesel olarak üretilen inaktive edilmiş virüs aşılarında görünme olasılığı vardır. Salk'ın teorisine göre, formaldehit tedavisi süresi ile tek doz aşıdaki canlı virüs sayısı arasında doğrusal olarak azalan bir ilişki vardır. Ancak her firmanın fiili işleyişinde, bu negatif ilişkinin doğrusal olmadığı ve formaldehit muamele süresi belli bir limiti aştıktan sonra inaktivasyon etkisinin kademeli olarak zayıfladığı bulunmuştur. Büyük miktarlarda Salk aşısı üreten beş şirketin tümü standartların altında ürünlere sahiptir.
Üretim açısından bakıldığında, Carter'ın laboratuvarının düzensiz çalışması kazanın ana nedenidir. Tüm şirketler standartların altında ürünlere sahip olsa da, Carter Laboratories'in aşısı aşı yapanlara en büyük zararı veriyor. Eli Lilly, Parker Davis ve Pittman Moore tarafından yapılan aşılama sonrası bildirilen vaka sayısı beklenen aralık dahilindeyken, Wyeth ve Carter Laboratories ürünlerinin advers reaksiyonları beklentileri aştı. Dahası, istatistiklere göre, Carter laboratuvar aşısının sakatlık oranı, Wyeth'in aynı ürününün yaklaşık on katı.
Diğer şirketlerle karşılaştırıldığında, Carter Laboratories'in aşı üretim sürecinde düzensiz operasyonları olduğu aşikâr.Filtrasyon süresini kısaltmak için, Carter Labs, eksik filtreleme ile cam filtreler kullanıyor. Cam filtre zaman zaman az miktarda virüs içeren hücre döküntüsünün geçmesine izin verir En virülan Mahoney suşunun kullanılması nedeniyle, hücre debrisini içeren tam olarak inaktive edilmiş aşılar, doğal suşlardan daha patojeniktir. Salk, deney sırasında cam filtreler de kullanmasına rağmen, filtrelenmiş ürünü birkaç gün içinde işlemden geçirdi ve Carter Laboratories, formaldehit inaktivasyonu için süreyi belirlemedi ve filtrelenen ürün birkaç hafta saklanabilir. Birkaç ay boyunca bile bu, şişenin dibinde küçük Vero hücre döküntülerinin oluşmasına neden olabilir. 16 saatlik formaldehit muamelesinden sonra, 14,500 bulaşıcı virüs partikülü ortaya çıktı ve 28 saatlik muameleden sonra, enfeksiyöz virüs partiküllerinin sayısı 38,000 idi Daha uzun süre formaldehit ile muamele edilen numuneler daha fazla virüs içeriyordu. Carter Laboratories'in düzensiz davranışı, Idaho'daki çocuklar için aşının inaktivasyonu sırasında sadece iki numunenin tespitini de içeriyordu ve zamanla hiçbir canlı virüs tespit edilmedi.
Düzenleyici bir bakış açısından, Carter kazası, Amerikan biyolojik ürünler laboratuvarı tarafından sürekli seri üretim deneyimi gerekliliğinin iptali ve denetimin deregülasyonu ile ilgilidir.
1952'de çocuk felcinin ölüm oranı 1920'den beri zirveye ulaştığından beri, ABD hükümeti salgını stabilize etmek için acil olarak çocuk felci aşısı tedarik etmelidir. 1954 yılında, Ulusal Polio Vakfı'nın (Başkan Roosevelt tarafından kurulan) finansmanı ile Salk, büyük ölçekli bir çocuk felci aşısı denemesi başlattı. Deney üç bölüme ayrılmıştır: operasyon planlaması, aşı deneme üretimi ve istatistiksel değerlendirme. Eli Lilly ve Parker Davis, aşının deneme üretiminden sorumludur ve güvenlik, Ulusal Sağlık Enstitüleri tarafından denetlenir. Pasifleştirilmiş virüs aşılarının belirli bir canlı virüs olasılığı olduğu için, Ulusal Sağlık Enstitüleri ve Ulusal Polio Vakfı, Eli Lilly ve Park Davis'in 11 parti stabil ve güvenli aşı üretmesini şart koşmaktadır. 1955'teki başarılı klinik denemenin ardından, çocuk felci aşısı resmi olarak ticari üretim aşamasına girdi.Üretim hızını artırmak için, Amerikan biyolojik ürünler laboratuvarı, Eli Lilly ve Park David'i istisna eden aşı üreticilerinin sürekli toplu üretimi için deneyim şartını iptal etti. Sri Lanka dışındaki üreticiler, sürekli olarak büyük miktarlarda çocuk felci aşısını güvenli bir şekilde üretme yeteneğinden yoksundur. Aynı zamanda, önceki klinik denemelerde ve deneme üretiminde, Ulusal Sağlık Enstitüleri, her aşı partisi üzerinde doku kültürü ve canlı hayvan testleri gerçekleştirdi. Takip eden ticari üretimde, maliyet ve verimlilik hususları nedeniyle, ABD biyolojik ürünler laboratuvarı her partiyi incelemedi ve bu da Carter'ın vasıfsız aşısının pazarlanmasına yol açtı.
Carter kazasından sonra, ABD makamları, teknik şartlarda ve düzenleyici kurumların düzeninde değişiklikler yaptı. Carter kazasının ana nedeni düzensiz çalışma olduğundan, biyolojik ürünler laboratuvarı Salk aşı üretim yönteminde daha iyi filtreleme, saklama ve güvenlik testi prosedürleri geliştirdi. Aynı zamanda, düzenleyici boşluklara yanıt olarak, federal hükümet Ulusal Sağlık Enstitüleri'ne daha fazla düzenleme sorumluluğu vermiş ve biyolojik ürünler laboratuvarını tek bir laboratuvardan Ulusal Sağlık Enstitülerinin 7 laboratuvarı olan bağımsız bir departmanına yükseltmiştir. , Biyolojik Ürünler Standartları Bürosu. 1956'da, bölümdeki aşıları yöneten profesyonellerin sayısı 10'dan 150'ye çıktı. 1972'de aşı denetleme sorumluluğu FDA'ya devredildi. 1987'de FDA Biyolojik Ürünler Standartları Bürosu'nu Biyolojik Ürünler Değerlendirme ve Araştırma Merkezi (CBER) ile birleştirdi ve aşı denetiminden sorumlu personel 250'den fazla kişiye çıkarıldı.
Carter kazasıyla başlatılan "hatasız sorumluluk" sistemi (yani, bir aşı advers reaksiyonunun kurbanı, şirketin ilgili aşı üretim sürecinde bir hata yapıp yapmadığını kanıtlamak zorunda değildir ve aşı üreticisinden doğrudan tazminat talep edebilir), aşı endüstrisinin 1970'den 1986'ya kadar yoğunlaşmasıdır. Artışlar ve yükselen aşı fiyatları sahneyi oluşturuyor . Duruşma sırasında Carter'ın laboratuarının üretiminde herhangi bir ihmal bulunmamasına rağmen (ancak usulsüzlükler mevcuttu), mahkeme yine de mağdura tazminat ödemesine karar verdi ve tekrar aşı üretmesini yasakladı. 1955 ile 1970 yılları arasında piyasada daha az aşı türü vardı ve üreticiler sistemden çok fazla etkilenmemişti. 1982 yılına kadar temelsiz bir çalışma DTP aşısının (DTP) bebeklerde ve küçük çocuklarda kalıcı beyin hasarına neden olacağını iddia etti. 1987'de 800 davanın toplamı 21 milyon ABD dolarının üzerindeydi. Aşı firmalarının devasa tazminat bedellerini ödeyebilmek için DTP aşıları dahil ürünlerin fiyatlarını arttırması gerekiyor buna rağmen birçok firma hala tazminat masraflarını karşılayamıyor ve piyasadan çekilmeyi tercih ediyor. Amerika Birleşik Devletleri'nde boğmaca aşısı üreten firma sayısı dörtten (Wyeth, Connaught, Skravo ve Ledley) bire (Ledley) indirilmiştir. 1986'da Ulusal Çocuk Aşı Yaralanmaları Yasası'nın yürürlüğe girmesine ve 1988'de Ulusal Aşı Yaralanmaları Tazminat Programının kurulmasına kadar aşı imalatçılarını düşürme eğilimi azaldı ve aşı fiyatları da düştü.
ABD aşı endüstrisindeki büyük ölçekli birleşmeler ve satın almalar esas olarak 1970'ler, 1980'ler ve 21. yüzyılın başlarında iki zaman diliminde yoğunlaştı ve bu iki zaman diliminde aşı endüstrisinin yoğunlaşmasında önemli bir artışa neden oldu. Aşı endüstrisindeki itici faktörler açısından, birleşme ve satın almalar iki kategoriye ayrılabilir: kaza nedenleri ve normal operasyonlar. Bunlar arasında, normal operasyonlar amacıyla satın almalar da iki kategoriye ayrılabilir: Büyük şirketler teknolojiyi özümser ve satın almalar yoluyla ürün hatlarını tamamlar ve küçük şirketler, rekabet güçlerini artırmak için kaynakları birleşme ve devralmalar yoluyla entegre eder.
Aşı şirketi bir güvenlik olayı nedeniyle satın alındı: 1968'de Parker Davis, DTP-çocuk felci aşısı Quadrigen'de yeterince araştırılmamış yardımcı benzetonyum klorürü kullandı ve bir bebekte ciddi bir yan etkiye neden oldu. Si, 650.000 dolar para cezasına çarptırıldı ve 1970 yılında Warner Lambert ilaç şirketi tarafından satın alındı. 1986'da, Amerika Birleşik Devletleri'ndeki Cyanamid, OPV aşılamasından sonra eski haline dönmesi ve aşı yapanlara karşı şiddetli yan etkiler nedeniyle on milyonlarca ABD doları para cezası aldı ve daha sonra 1994 yılında AHP tarafından satın alındı (Wyeth yan kuruluşu). Chiron, üretim atölyesi standartları karşılamadığı için 2004 yılında durduruldu. Bir zamanlar Amerika Birleşik Devletleri'ndeki iki büyük grip aşısı üreticisinden biriydi ve pazar payının yaklaşık% 50'siydi. 2005 yılında, Novartis, Chiron'u satın alarak ABD aşı pazarına girdi.
Büyük şirketler teknoloji edindi ve ürün hatlarını tamamladı: Pfizer, kızamık aşıları Pfizer-Vax Kızamık-K ve Pfizer-Vax Kızamık-L'nin düşük performansı nedeniyle 1979'da aşı pazarından çekildi. 2000 ve 2009'da Pfizer, Warner Lambert ve Wyeth aşı endüstrisine geri döndüler.Wyethin 13 valentli Preliminary aşısının satın alınmasıyla Pfizer, ABD aşı devlerinden biri haline geldi. 2007'de AstraZeneca, grip aşısı üreticisi Medimmune'u satın alarak grip aşısı FluMist'i satın aldı. 2008'de aşı ABD pazarının yaklaşık% 10'unu oluşturuyordu. Benzer satın almalar yoluyla, büyük şirketler belirli bir pazar payına sahip olmak için temel aşı çeşitlerini veya önemli aşı teknolojilerini elde eder.
Küçük ve orta ölçekli işletmeler, birleşme, satın alma ve kaynakların entegrasyonu yoluyla rekabet güçlerini artırıyor: 1989'da, Sanofinin selefi, Fransız aşı üreticisi Mé rieux Institute, Connaught Laboratories'i satın aldı. Daha önce, Mé rieux Institute, ABD pazarında onaylanmış ürünlerden yoksundu ve Connaught ABD pazarındaydı. Staphylococcal toksin, tüberkülin, tetravalan menenjit aşısı ve Hib aşısı gibi ürünlere sahip olmak. 1989'da Cyanamid'in ABD'deki bir yan kuruluşu olan Ledley Laboratories, Hib aşısını elde etmek için Praxis'i satın almak için 238 milyon harcadı ve 1994'te DTP-Hib kombinasyon aşısını başlatmak için kendi DTP aşısıyla birleştirdi.
içinde ABD aşı onay süreci ile pazarlama sonrası denetimin karşılaştırılması
Çin ve Amerika Birleşik Devletleri'nin aşı pazarlaması için benzer onay prosedürleri ve gereksinimleri vardır Aradaki fark, Amerika Birleşik Devletleri'nin daha eksiksiz bir rutin denetim mekanizmasına ve pazarlama sonrası izleme sistemine sahip olmasıdır. Çin'de, GMP sertifikası ve üç parti aşı tutarlılık sistemi doğrulaması, aşıların pazar öncesi onayında daha önemlidir. İkincisi, Çin Gıda ve İlaç İdaresi'nin denetim ekibi tarafından yerinde denetim sırasında gerçekleştirilir. Anahtar ara ürünler örneklenir ve test edilir ve son denetim Numunelerin doğrulanmasından hastane sorumludur. Aşı onaylandıktan sonra, yalnızca işletmenin kendi kendine denetimi ve Çin Teftiş Enstitüsünün parti düzenlenmesi (2016'dan önce nispeten az sayıda habersiz denetim vardı).
Amerika Birleşik Devletleri 1902'den beri aşı endüstrisi için bir üretim ve satış lisanslama sistemi uygulamaktadır. GMP, ilaç (aşı dahil) üreticilerinin karşılaması gereken en düşük standartlardan biridir. FDA, aşıların güvenliğini, saflığını ve etkililiğini test etmek için aşı doğrulamasından özel olarak sorumlu olan OVRR departmanı kurmuştur. Amerika Birleşik Devletleri Farmakopesi USP35'te yazılan prosedürlere göre, üreticilerin her bir yarı bitmiş ürün ve bitmiş ürün grubunun numunelerinin yanı sıra kendi kendine denetlenen stabilite, potens testleri ve diğer genel testlerin (güvenlik, pH, vb.) Sonuçlarını FDA'ya sağlaması gerekir. FDA sonuçları değerlendirip numunelerin güvenliğini, saflığını ve etkinliğini onaylarken, OVRR uzmanları ve Biyolojik Ürünler Komitesi üyeleri şirket üzerinde yerinde kontroller gerçekleştirir ve şirket, FDA testini ve doğrulamasını geçtikten sonra bir üretim lisansı alabilir. Pazarlama sonrası üreticiler, her bir grup öz denetim sonuçlarını ve numuneleri FDA'ya sunmalıdır ve FDA, aşı şirketlerinde onay sonrası denetimleri gerçekleştirecektir.
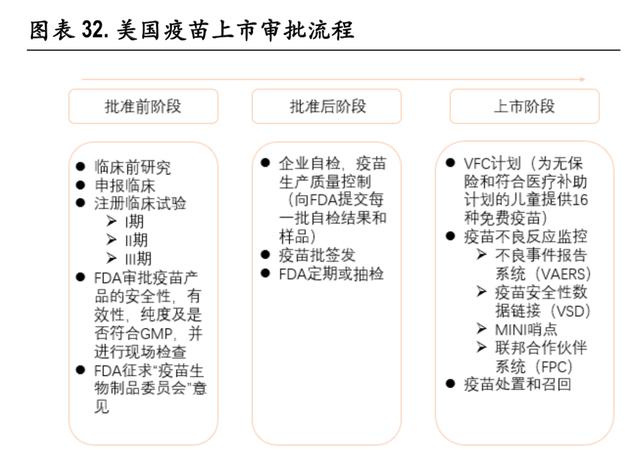

Günlük denetimler açısından, Çinin mevcut uçan denetim sistemi, ABD FDAnın Biyolojik İnceleme Ekibi sisteminin süreç yönetimi konseptine yavaş yavaş yaklaşmaktadır, ancak farklı cezalar ve farklı ayrıntı düzeyleri gibi hala birçok farklılık vardır. Bekle. 2015 yılında Çin Gıda ve İlaç İdaresi, ilaç güvenliği risklerinin önlenmesi ve kontrolünü güçlendirmeyi öneren "İlaçların ve Tıbbi Cihazların Habersiz Muayenelerine Yönelik Önlemler" i yayınladı ve şikayetlerin kontrol edilmesi ve sorunların bildirilmesi, ürün kalitesi risklerinin araştırılması, olumsuz ilaç olaylarının araştırılması ve rastgele gözetim koşulları altında yapılması gerektiğine açıklık getirdi. Uçuş muayenesi ve uçuş muayenesinin ana otoritesi, ulusal birinci seviye düzenleyici kurumdan il düzeyindeki düzenleme kurumuna delege edilmiştir. Aynı zamanda, uçuş muayenesinden sonra bir süre içinde düzeltme, uyarı mektubu yayınlama, araştırılan kuruluşla görüşme, ilgili ürünü geri çağırma, sertifika sertifikasını alma, üretimi askıya alma, soruşturma için dava açma ve diğer kararlar gibi daha hedefli yöntemler vardır.
ABD biyolojik ürün denetim modeli, 1997 yılında FDA tarafından oluşturulmuş ve aşı, Gözetim Hizmetleri Ofisi (ORA) öncülüğünde 1999 yılında düzenleyici kapsama dahil edilmiştir. 1999'dan önce FDA'nın aşı şirketlerini incelemesi bazı bilimsel ve teknik konularla sınırlıydı ve daha sonra kalite kontrol, üretim kayıtlarının saklanması, üretim ekipmanlarının temizlenmesi, personel nitelikleri, laboratuvar kontrolü ve diğer konularda daha kapsamlı denetimler gerçekleştirildi. Örneğin, 1999'da yapılan denetim, Parkedale'nin grip virüsü aşılarının üretim ve süreç kontrolünde CGMP'ye uygun olmayan kusurlara sahip olduğunu buldu.2000'deki denetim sırasında, hala uyumsuzluklar olduğu bulundu ve Parkedale grip aşılarının üretimini derhal durdurdu. Müzakereler, incelemeler ve düzeltmeler Kaçırılan grip sezonu ve yüksek düzeltme maliyeti nedeniyle, Parkedale sonunda grip aşısı pazarından çekildi. 2002 yılında, denetim Wyeth'in CGMP düzenlemelerini ihlal ettiğini ortaya çıkardı, bu nedenle Wyeth 30 milyon ABD doları para cezasına çarptırıldı. Denetim daha sıkı hale geldikçe, grip aşısı hükümet tarafından satın alındı, fiyat düşüktü ve piyasa talebi tam olarak tahmin edilemedi. Kâr edin ve bu nedenle grip aşısı pazarından çekilin. Biyolojik ürün denetimi ve düzeltmesi, aşı üreticilerinin maliyetini artırdı Çocukluk aşılarının en büyük alıcısı olarak (ABD'nin satın alımlarının yarısından fazlası), ABD CDC bu aşılar için bir fiyat tavanı belirledi ve üreticiler fiyat artışları yoluyla transfer edemezler. İnceleme ve düzeltme maliyeti nihayetinde pazarın arzını etkiledi ve hatta 2000'den 2002'ye kadar ABD pazarında bazı aşı çeşitlerinin eksikliğine neden oldu. Örneğin, 2000 sonbaharında Amerika Birleşik Devletleri'nde çocuklar için aşı sıkıntısı vardı. Başlangıçta difteri ve tetanoz aşısı (TD) ve grip aşısı sıkıntısı vardı. 2001 yılının Ocak ayında, DTaP aşısı ve streptococcus pneumoniae aşısı (PCV) sıkıntısı görülmeye başlandı, ardından da kızamık aşısı görülmeye başlandı ( MMR) ve suçiçeği aşıları Ekim 2001'de kıtlıktayken, hepatit B ve Hib aşıları da kıtlıktaydı.
FDA, biyolojik ürünlerin denetiminde Seviye I veya Seviye II'nin benimsenmesini şart koşar.Seviye I, altı kalite sistemi, fabrika tesisi ekipman sistemi, malzeme sistemi, üretim sistemi, paketleme ve etiketleme sistemi ve laboratuvar kontrol sisteminin derinlemesine bir entegrasyonudur. Şirketin CGMP ile uyumlu olup olmadığını değerlendirmek için, bu yöntem genellikle ilk CGMP sertifikasyonu veya ciddi advers ilaç reaksiyonları veya tekrarlanan şikayetler meydana geldiğinde gerçekleştirilir. Seviye II genellikle kalite ve üretim sisteminin ve diğer sistemlerin iki yılda bir periyodik olarak gözden geçirilmesidir.Bu rutin inceleme genellikle sertifika yenileme veya GMP geçmişine uyulmaması ile gerçekleştirilir. Yasa uygulama sürecinin katı ve yasal olmasını sağlamak için, inceleme süreci ve sonuçlarının standart bir süreci vardır (kusurlar varsa):
- Müfettiş bir Form 483 (Form 483) yayınlar ve kesin bir denetim raporu (EIR) hazırlar ve bunu FDA bölge ofisi veya merkez ofisinin başına sunar;
- Denetlenen şirket, 483 formunda listelenen kusurlara imzaladıktan sonra 15 iş günü içinde yanıt verecek ve FDA tarafından verilen bir EIR alacaktır;
- (483)FDA(WarningLetter) 15;
- (Consent Decree) Consent Decree FDA(30)
( VAERS VSD)( Sentinel Initiative )FDA
VAERS Rotashield LYMERix VAERS1. Rotashield FDA Rotashield 1999 VAERS Rotashield ( )(ACIP)Rotashield 1200 2. 1998 FDA LYMERix()LYMERix OspA III LYMERix VAERS 905 (HLA) DR4 +OspA( LYMERix )OspA 2002 LYMERix
2008 5 FDA (MINI-Sentinel)(FPC) 18 1.8 FDA FDA VAERS
:200519 120 2005 2009 10 8
:2016 25 24 2017
: 2015 2008 2018
2018 2019 6 29 12 1 ; ;
96 6 ( 15-50 10-30 15-50 10-20 ) 45 ;
Hatırlatma: Orijinal belgeye ihtiyacınız varsa, bu raporu aramak ve indirmek için gelecekteki düşünce kuruluşu www.vzkoo.com'da oturum açabilirsiniz.
En son içeriği zamanında almak için herkese açık "Future Think Tank" hesabını takip edin.
-
- Hindistan'da yeni doğan bebek annesi tarafından terk edildi. Sokak köpeği hayatını kanalizasyondan kurtardı
-

- Sincan'ın sırlarında saklı, yaz aylarında ortalama 22 ° C sıcaklıkta olan bu otlak şaşırtıcı derecede güzel
-

- Lunengin ikinci transferinde takımın dördüncü şahsiyeti olan 20 yaşındaki genç geçici olarak memleketine döndü, yedek ekip 8 gol attı.
-

- Sadık köpek Xiaobai "yol kenarına yapışıyor" ve sahibini bir buçuk yıl "hiç ayrılmadan" bekliyor: Burada kalmak istiyorum ...
-

- Sonuna kadar bir siyah! 37 buçuk yaşında emekli olan eski milli oyuncu, arka arkaya dört milli oyuncu kazandı ve 19 yıl sonra tekrar kazandı.
















