İlaç endüstrisi hakkında özel rapor: CAR-T, ticarileştirme sorunsuz bir şekilde ilerliyor ve pazar potansiyeli hala değerlendirilmeyi bekliyor
Raporu almak için, lütfen Future Think Tank www.vzkoo.com'da oturum açın.
1. CAR-T geliştirmenin temel durumu
1.1 Geliştirme geçmişi
19. yüzyılda New York'ta bir cerrah olan William B Coley, sarkom hastalarına bakteriyel toksinlerin (yani Coley toksinlerinin) enjekte edilmesindeki öncü çalışmasından dolayı kanser immünoterapisinin öncülerinden biri olarak kabul edilmektedir. Bazı durumlarda, enjeksiyon tedavisi hastadan objektif bir tepki gösterdi. Ancak sonraki yıllarda, bu immünoterapi teknolojisi çığır açan bir ilerleme sağlamadı. Miller ve meslektaşları timus fonksiyonunu ve T lenfositlerini keşfettikçe ve insanların bağışıklık sisteminin hücresel bileşenlerine olan ilgisi arttığında, immünoterapi yavaş yavaş daha fazla ilerleme kaydetti.
1.1CAR-T tanımı ve uygulama süreci
Kimerik Antijen Reseptör T-Hücre İmmünoterapisinin kısaltması olan CAR-T, tümör tedavisi için yeni bir hassas hedefli tedavi türüdür. T hücrelerini hastanın kendi bağışıklık sisteminden çıkarır, kültürler ve bunları in vitro olarak hedef antijen reseptörüne dönüştürür ve ardından değiştirilmiş T hücrelerini hastanın vücuduna geri enjekte eder. T hücreleri, tümör tedavisine ulaşmak için belirli kanser hücrelerini tanır ve bunlara saldırır. etki. CAR-T teknolojisi, iyileştirici etki ve ilaç dışı direnç gibi avantajları nedeniyle, 2013 yılında Science dergisi tarafından dünyadaki en iyi on bilimsel ve teknolojik yenilik olarak derecelendirildi.
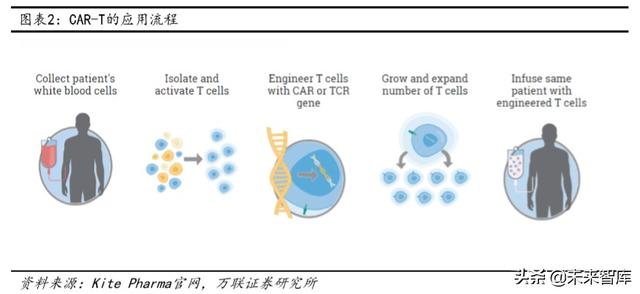
CAR-T başvuru süreci esas olarak aşağıdaki beş adıma bölünmüştür:
İzolasyon: T hücrelerini kanser hastalarından izole edin.
Modifikasyon: Tümör hücrelerini tanıyabilen ve CAR-T hücrelerini hazırlamak için T hücrelerini aktive edebilen kimerik antikorları eklemek için genetik mühendisliği teknolojisini kullanın.
Genişleme: In vitro kültür, CAR-T hücrelerinin çok sayıda genişlemesi.
Reinfüzyon: Genişletilmiş CAR-T hücreleri hastaya yeniden infüze edilir.
Gözetim: Özellikle birkaç gün önce vücudun şiddetli reaksiyonunu kontrol etmek için hastayı yakından izleyin.
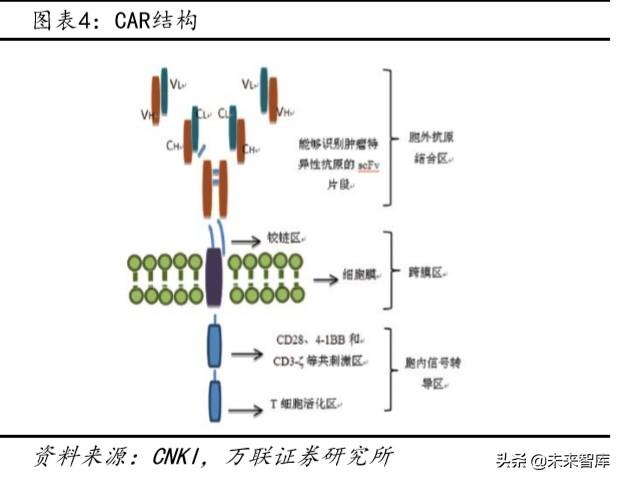
1.2 CAR-T yapısı ve prensibi
Klasik kimerik antijen reseptörü CAR (CAR) genel olarak 5 bileşene sahiptir, yani antikorun tümör antijenlerini tanıyan tek zincirli fragman değişkeni (tek zincirli fragman değişkeni, scFv) ve klasik kimerik antijen reseptörü CAR (kimerik antijen reseptörü, CAR) genel olarak beş bileşene sahiptir, yani tek zincirli fragman değişkeni (scFv), menteşe alanı, transmembran alanı, kostimülatör alanı ve tümör antijenlerini tanıyan bir antikorun T hücresi aktivasyon alanı. CAR-T hücre immünoterapisi, tümöre özgü antijenleri tanıyan ve bunları CD28, 4-1BB ve CD3- gibi T hücresi aktivasyonunda yer alan bir dizi molekülden oluşan bir transmembran zincirinde füzyon yapabilen scFv parçalarını modifiye etmek için genetik mühendisliği kullanır. Yukarıdaki paragrafta, T hücreleri, tümör hücrelerinin yüzeyindeki spesifik antijenlere doğrudan bağlanarak etkinleştirilir ve perforin ve granzim B'yi serbest bırakarak tümör hücrelerini doğrudan öldürebilirler. Çünkü CAR-T, kostimülatör moleküler sinyaller yoluyla T hücresi bağışıklığının öldürücülüğünü artırabilir, böylece MHC ekspresyonunu aşağı regüle eden veya kostimülatör moleküllerin sekresyonunu inhibe eden tümör hücrelerinin neden olduğu bağışıklık kaçışının üstesinden gelir. Bu, CAR-T hücre teknolojisini belirli bir dereceye kadar çok hedefli hale getirir ve aynı antijeni ifade eden tümörleri tanıma ve öldürme yeteneğine sahiptir.
1.3 CAR-T'nin avantajları ve dezavantajları
Mevcut CAR-T teknolojisinin avantajları çok açıktır: hematolojik tümörler için, özellikle de büyük B lenfosit tümörleri için, diğer anti-tümör tedavileriyle karşılaştırıldığında, remisyon oranı ve diğer göstergeler önemli ölçüde iyileştirilmiştir ve ayrıca düşük ilaç direncine sahiptir. Cinsiyet gibi avantajlar ve daha az yan etki. Bununla birlikte, uygulaması da sınırlıdır Bir yandan, CAR-T teknolojisinin uygulanması altındaki klinik ilerleme esas olarak hematolojik tümörlerden gelir ve katı tümörler, karmaşık tümör iç ortamı ve diğer nedenlerden dolayı nispeten az ilerleme gösterir ve etkililik tatmin edici değildir; Öte yandan, CAR-T ayrıca sitokin salınım sendromu (CRS), hedef dışı toksisite, nörotoksisite vb. Gibi teknik eksikliklere ve toksik yan etkilere sahiptir ve hatta reaksiyon şiddetli olduğunda yaşamı tehdit eder. Ek olarak, CAR-T standardize edilmemiş bir ürün olduğundan, yüksek tedavi maliyeti de uygulamasının genişletilmesinde bir problemdir. Yeni ortaya çıkan bir teknoloji olarak CAR-T, uzun vadeli etkinlik ve güvenlik açısından hala daha fazla araştırma ve gözlem gerektirmektedir.
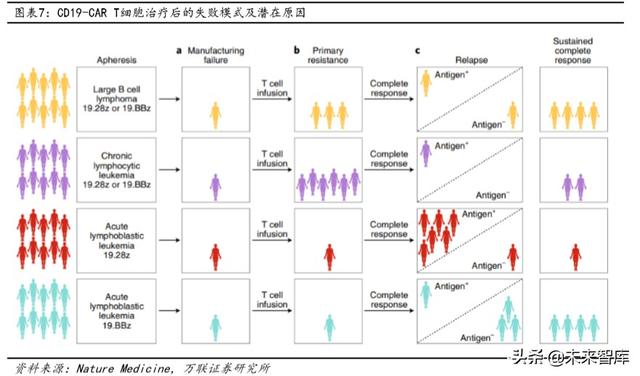
Bununla birlikte, en iyi uygulama etkisine sahip hematolojik tümörler alanında bile, CAR-T preparasyonu yüksek bir teknik hazırlık başarısızlık oranına sahiptir.Büyük B hücreli lenfoma ve kronik lenfositik lösemi gibi birçok hematolojik tümör için hazırlanışı başarısız olur. Oranlar% 10 civarında. Ek olarak, farklı tümör türlerinin klinik belirtileri, yanıtları ve nüksleri tamamen aynı değildir.CAR T ilk kez kullanıldığında, B-ALL hastalarının yaklaşık% 80'inin farklı başlangıç tedavi etkileri seviyeleri vardır ve yalnızca 10 Hastaların yaklaşık% 'si ilaç direnci geliştirir. KLL hastalarının sadece yaklaşık% 30'u başlangıçta terapötik etkiye sahiptir ve hastaların% 60'ı ilaca direnç geliştirmiştir. CD19.28z-CAR T tedavisinden sonra akut lenfoblastik lösemili hastaların nüks oranının diğer hematolojik tümörlere göre önemli ölçüde daha yüksek olduğunu belirtmek gerekir.
1.4 CAR-T teknolojisi ilerlemesi
Araştırmacıların CAR-T teknolojisini sürekli olarak geliştirdiği ve yükselttiği yukarıdaki teknik kusurlara ve advers reaksiyonlara yanıt olarak bir yandan, CAR-T teknolojisinin daha fazla tasarlanmasıyla, katı tümör hedeflerinin etkinliği güçlendirilir ve tedavi etkisi geliştirilir. Öte yandan, CAR-T kostimülatör faktörler de hücre aktivasyonunu iyileştirmek için kullanılabilir. Çoğu katı tümör için, hedef olarak kullanılabilen tümör markörleri veya spesifik moleküler mutasyonlar genellikle hücrede veya hücre yüzeyinde ifade edilir ve özgüllük yüksek değildir. Ek olarak, katı tümörlerin heterojenliği, farklı hastaların tümörlerini yapar ve farklı metastatik bölgeler, alt tip aynı olsa bile farklı genetik tiplere sahiptir, bu nedenle tedavi etkisi iyi değildir. Çift hedefli CAR'lar (Dual CAR'lar), "tandem" CAR'lar (Tandem CAR'lar) ve "universal" CAR'lar (Universal CAR'lar) gibi CAR-T'nin katı tümör hedeflerine bağlanmasının etkinliği daha fazla ARABA tasarımı ile geliştirilebilir. , Tedavi etkisini geliştirin.
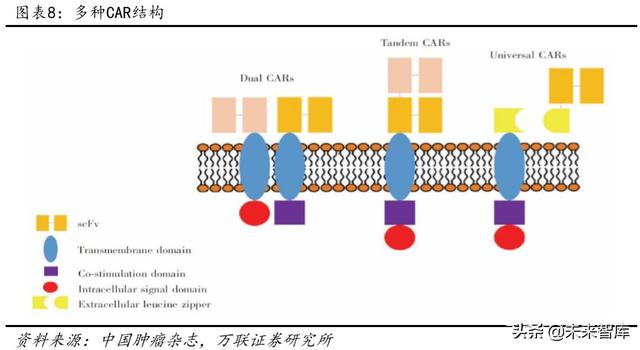
Farklı CAR-T faktör modifikasyon teknolojileri sayesinde, tümör hücrelerinin CAR-T hücreleri tarafından spesifik olarak tanınması ve CAR-T hücrelerinin aktivasyonu ve proliferasyonu artırılır. Şu anda, CAR-T teknolojisi dört nesil araştırma ve geliştirmeden geçmiştir: ilk nesil esas olarak CD3'den oluşur ve beşinci nesil evrensel kimerik antijen reseptörleri alanına doğru ilerler.
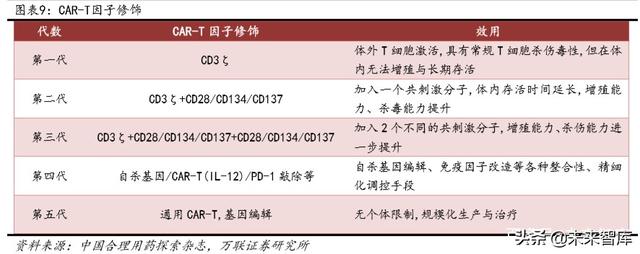
1.5 Ana CAR-T ürünleri
Şu anda, iki CAR-T ürünü ticarileştirildi ve büyük ölçekli satışlar gerçekleştirdi: Gilead's Kite'den Yescarta ve Novartis'ten Kymriah. Her iki hedef, esas olarak B hücreli lenfoma için CD19'dur. İlki, 2017'de FDA tarafından onaylandı ve ertesi yılın Ağustos ayında EMA tarafından onaylandı. İleride pazarın dikkatini çekecek bir ürün var, yani Nanjing Legend ve KingScript'in ortak geliştirdiği LCAR-B38M, Johnson & Johnson'ın dikkatini çekmiş ve dikkat çekici iyileştirici etkisiyle bir işbirliğine ulaşmıştır.Nanjing Legend ayrıca Johnson & Johnson'dan 350 milyon ABD doları tutarında ön ödeme almıştır. Sonraki dönüm noktası ödemeleri ile anlaşma.
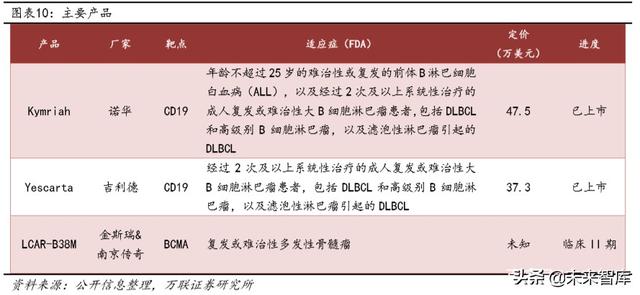
Kymriah:
CAR-T ürünü, Novartis tarafından geliştirildi ve Ağustos 2017'de dünyanın ilk onaylanmış pazarlanan ürünü oldu. Pazarlama temeli temelde ELIANA çok merkezli klinik araştırmaya dayanıyordu. Bu klinik araştırmada, 63 hasta nüks etti veya tedaviye yanıt vermedi B hücreli akut lösemili hastalar (B-hattı r / r ALL) sonunda çalışmaya dahil edildi. Bunların arasında hastaların% 83'ü (52) objektif remisyona ulaştı ve% 63'ü (40) tam remisyon elde etti. Hastaların% 49'u 3. derece ve üstü KRS yan etkileri yaşadı ve hastaların% 18'i 3. derece ve üstü nörolojik olaylar yaşadı (spesifik semptomlar arasında baş ağrısı, koma, anksiyete, epilepsi vb.) Serebral ödemli hastalar.
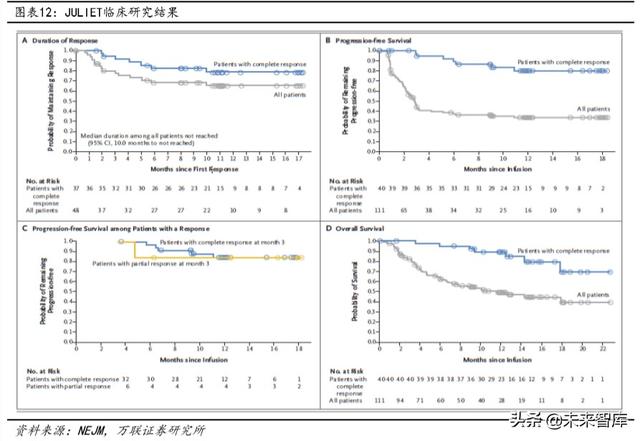
2018 yılında FDA, Kymriah'ın nükseden / refrakter büyük B hücreli lenfoma tedavisi için klinik endikasyonlarını artırdı.Bu karar temel olarak JULIET çalışmasının iyi sonuçlarına dayanıyordu. Kymriah'ın etkililik analizinde, nükseden / refrakter diffüz büyük B hücreli lenfoma (R / R-DLBCL) olan toplam 68 hasta nihayet çalışmaya dahil edildi.Sonuçlar, hastaların genel yanıt oranının (ORR)% 50'ye ulaştığını ve bunların tamamen Yanıt oranı (CR)% 32'ye, kısmi yanıt oranı (PR)% 18'e ulaştı ve medyan yanıt süresine (DOR) henüz ulaşılmadı. Kymriah'ın R / R-DLBCL tedavisinde önemli bir etkiye sahip olduğu görülebilir. Şu anda, Novartis Kymriah, Ağustos 2019'da CDE'ye bir klinik başvuru sunmuştur. Danıştay Genel Ofisi'nin "İnceleme ve Onay Sisteminde Reformun Derinleştirilmesi ve İlaçlarda ve Tıbbi Cihazlarda Yeniliğin Teşvik Edilmesine İlişkin Görüşler" e göre Novartis, klinik araştırma uygulamaları için zımni izni almıştır. Ancak Kymriah listelemede daha fazla ilerleme kaydetmedi.
Yescarta:
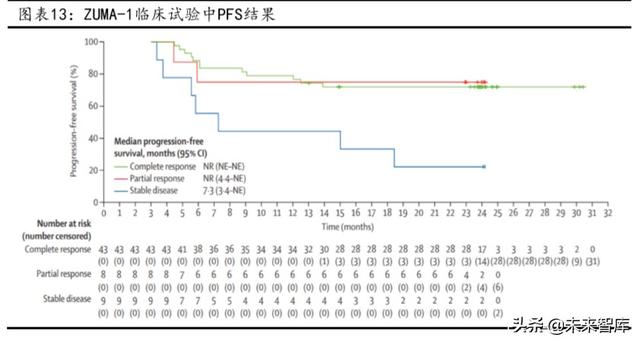
Yescarta'nın ZUMA-1 klinik çalışma sonuçları mükemmel. Medyan 15.4 aylık takip süresiyle ZUMA-1 çalışmasında, refrakter büyük B hücreli lenfoma (DLBCL) için Yescarta ile tedavi edilen hastalar arasında% 82 (89/108) objektif remisyon ve% 58 tam remisyon elde etti.
Uzun vadeli etkinlik ve güvenliğin daha fazla değerlendirilmesinden sonra, araştırmacılar, nükseden / refrakter DLBCL için Yescarta tedavisinin kalıcı remisyona neden olabileceğini buldu; ZUMA-1 kritik faz 2 kohortunda 47, Yescarta'nın tek bir infüzyonundan sonra Refrakter B hücreli büyük lenfomalı hastaların% 'si üç yıldan fazla hayatta kaldı; hastaların medyan genel sağkalımı 25.8 aydı ve uzun vadeli güvenlik iyiydi.
Yescartanın yerel klinik köprüleme denemesi başarıyla tamamlandı ve listeleme için ilan edildi (Yikelilunsai enjeksiyon). Beyan sahibi Fosun Kate Biotechnology Co., Ltd.'dir (Fosun Kate, Shanghai Fosun Pharmaceutical Group ve Gilead Sciences, ABD). İlaç ortak girişimi). Takip sürecinin sorunsuz ilerlemesi ve pazara başarılı bir şekilde girmesi, ülkemiz ilaç firmalarının uluslararası işbirliğinde de önemli bir kilometre taşı olacak, yerli ilaç firmaları ile dünyanın gelişmiş firmaları arasındaki temasın hızlanması ve derinleştirilmesi açısından olumlu bir öneme sahip olacaktır.
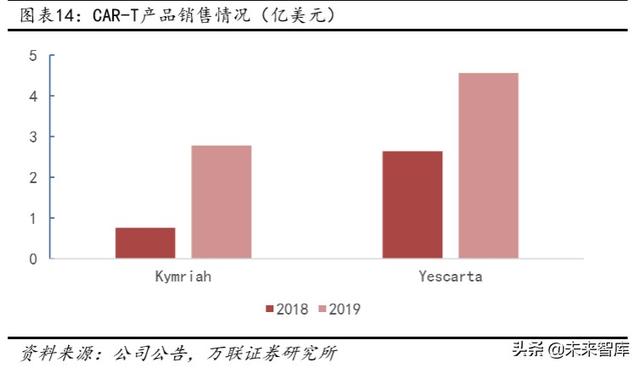
Bununla birlikte, Aralık 2019'da Bristol-Myers Squibb'in (BMS), Gilead'e karşı, Juno Therapeutics ve Sloan Kettering Cancer Center'a 752 milyon ABD Doları ödemesi gerektiğine karar veren bir dava kazandığını ve bunun 585 milyon ABD Doları tazminat olduğunu belirtmek gerekir. Geri kalanı ise Yescarta tarafından satılan telif hakkının% 27,6'sıdır.İki taraf arasında CAR-T ile ilgili sonraki patent davası devam edebilir. 2019 yılında Yescarta ve Kymriah sırasıyla 456 milyon ABD doları ve 278 milyon ABD doları satış gerçekleştirerek yıllık bazda önemli bir büyüme kaydetmiştir.
LCAR-B38M:
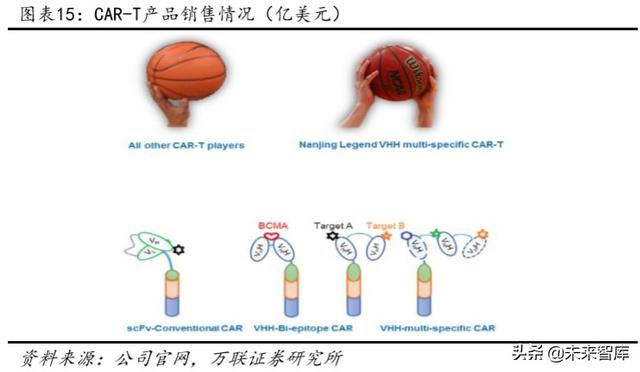
CAR-T ürünü Nanjing Legend tarafından GenScript altında geliştirilmiştir.Ürün, bir 4-1BB kostimülatör alanı ve hedefi "iki elinizle basketbolu tuttuğunuz gibi" daha sıkı ve doğru bir şekilde bağlayan tek alanlı antikorları hedefleyen iki BCMA içerir. Antikor afinitesi iyileştirildi ve% 100'lük bir toplam remisyon oranı ile büyük bir uluslararası tepkiye neden oldu.
Ürün 2018 yılında Devlet İlaç İdaresi'nden CAR-T klinik araştırma uygulaması (IND) onayını aldı. Johnson & Johnson ile yapılan işbirliği anlaşmasında, Johnson & Johnson ve Legend Biotech, multipl miyelom için CAR-T hücre tedavisini ortaklaşa geliştirmek için küresel bir stratejik işbirliği anlaşması imzaladı ve ortak olarak LCAR geliştirmek, üretmek ve satmak için 350 milyon ABD Doları tutarında bir avans ödedi. -B38M, Greater China bölgesi, Yang Sen ve Legend Biotechnology, diğer bölgelerde 3: 7 ve 5: 5 oranında maliyetleri ve faydaları paylaşarak Çinli ilaç şirketlerinin yabancı patent yetkilendirmesi için en büyük peşinat rekorunu ve işbirliği için en iyi koşulları belirledi. 2019'da, Avrupa İlaç Ajansı (EMA) Öncelikli İlaç Tanımlama (PRIME) yeterlilik sertifikasını alan Çin'de ilk CAR-T ürünü oldu.
American Society of Hematology (ASH) ve American Society of Clinical Oncology'nin (ASCO) 2017 yıllık toplantısında, LCAR-B38M'nin klinik verileri şaşırtıcı bir şekilde performans gösterdi.Nükseden veya ilaca dirençli multipl miyelomlu 35 hastayı içeren bir klinik araştırmada Denemede, bu tedavinin objektif remisyon oranı% 100'e ulaştı ve multipl miyelom için klinik etkinliği mevcut tedavilerden daha iyidir ve multipl miyelom için önemli bir yeni tedavi haline gelecektir.
Takip eden Legend-2 çalışmasında (Klinik Deneme numarası NCT03090659, relaps / refrakter multipl miyelomlu hastalarda LCAR-B38M'yi değerlendirmeyi amaçlayan, devam eden, tek kollu, açık çok merkezli bir faz I klinik çalışmadır ( 18-80 yaş), toplam 57 hastaya LCAR-B38M CAR-T hücre reinfüzyonu yapıldı ve toplam yanıt oranı (kısmi yanıt oranı PR veya daha iyisi)% 88'e ulaştı, bunlardan 42 hasta ulaştı Medyan 16 aylık remisyon süresi (DOR) ve mükemmel klinik verilerle tam remisyon elde edildi.
Ayrıca, Amerika Birleşik Devletleri'nde relaps / refrakter multipl miyelom (Klinik Deneme No. NCT03548207) tedavisi için LCAR-B38M'nin faz 1/2 klinik çalışması gerçekleştirilmiştir.
Diğer CAR-T ürünleri:
bb2121:
Şu anda CAR-T alanında Bristol-Myers Squibb gibi pek çok üretici var. Şirket, Celgene'nin Juno'yu satın aldığı CAR-T ürün hattı da dahil olmak üzere tüm CAR-T ürünlerini elde etmek için 2019 yılında Celgene'i satın aldı.
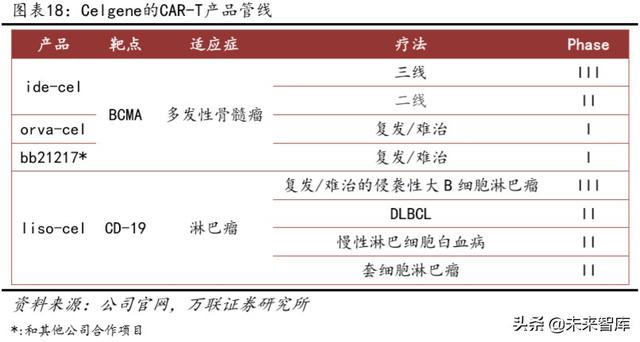
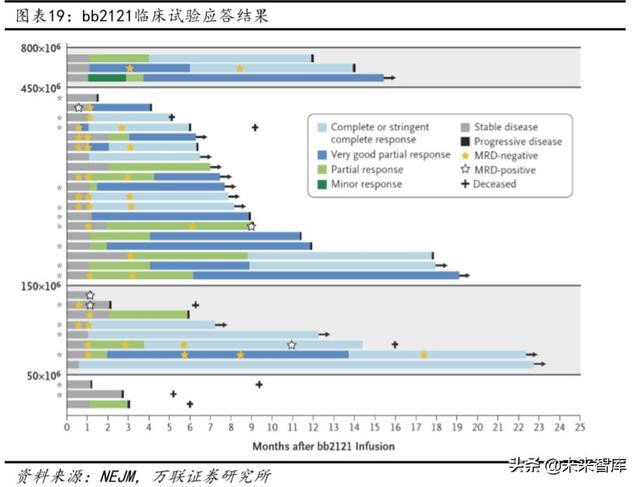
Yukarıdaki boru hatlarına ek olarak, bb2121, Celgene ve BluebirdBio tarafından ortaklaşa geliştirilen bir CAR-T ürünüdür.Klinik bir enjeksiyon dozu artırma denemesinde, tedavi gören 33 hastanın genel yanıt oranı% 85'ti ve CAR-T enjeksiyon miktarı aşıldı 150 × 106 hasta grubunda, daha iyi kısmi yanıtlar (Çok iyi kısmi yanıtlar) ve tam yanıtlar gözlemlenebilir. Ortalama PFS 11,8 aya ulaştı. Klinik etki iyidir. Bununla birlikte, tam remisyonu olan hastalarda nüks oranı nispeten yüksektir ve gelecekte daha uzun ürün ayarlamaları ve klinik verilere ihtiyaç duyulabilir.
CD19 oto-kimerik antijen reseptörü T hücresi infüzyonunu hedefleme:
Bosheng Ji'anke Cell Technology Co., Ltd. 17 Kasım 2016'da kurulmuştur ve kayıtlı adresi No 4, Haiguan Road, High-tech Zone, Hefei City'dir. Kurulduğu günden bu yana BOSUN Gianco, CAR-T hücre GMP hazırlama atölyesi, plazmid ve lentivirüs GMP üretim ve saflaştırma atölyesi ve uluslararası birinci sınıf seviyeye ulaşabilen P2 güvenlik laboratuvarı dahil olmak üzere 2.000 metrekarelik inşaat alanı ile donanım inşaatını tamamladı. Ve iyi donanımlı kalite kontrol laboratuvarı ve Ar-Ge laboratuvarı. BOSUN Gianco, kendi Ar-Ge laboratuvarını kurmuş ve plazmitlerden, lentivirüsten CAR-T hücre hazırlığına kadar tam zincir üretim sistemi kurmuştur.Şimdiye kadar Çin'deki en eksiksiz tam otomatik ve tamamen kapalı CAR-T hücresidir. İşletmelerin üretim hattı.
Şirketin ilk yeni ilaç araştırma ve geliştirme projesi olan CD19-CAR-T, "CD19 oto-kimerik antijen reseptörü T hücresi infüzyonunu hedefleyen" yeni bir ilaç klinik denemesi (kabul numarası: CXSL1700216) için başvuruda bulundu ve 6 Aralık 2019'da bunu elde etti Devlet İlaç İdaresinin İlaç Değerlendirme Merkezi tarafından resmi olarak onaylanmıştır. Şu anda, şirketin Hodgkin dışı lenfoma, multipl miyelom ve çeşitli katı tümörleri (üç negatif göğüs kanseri, karaciğer kanseri, akciğer kanseri, pankreas kanseri, kolorektal kanser vb.) Kapsayan bir dizi ilacı da bulunmaktadır.
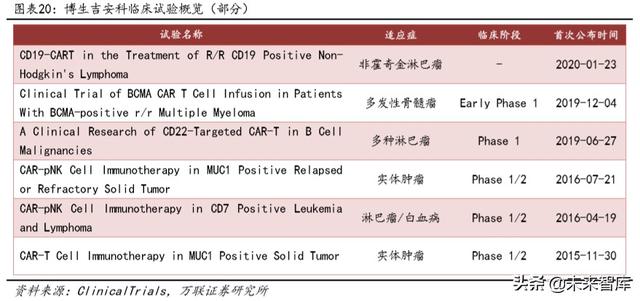
Şirket ve Hefei First Peoples Hospital tarafından Mucin1 ve PD-1 çift hedef inhibisyonu için hücresel immünoterapi klinik araştırma denemesinde, lentiviral yük hem anti-Mucin1 hem de anti-PD-L1 (PD-1 Vücut) İki Kimerik Antijen Reseptörü (CARs) molekülüne sahip NK92 hücreleri, nihai efektör hücreler olarak PD-1 / MUC1CAR-pNK92 hücrelerini oluşturmak için NK92 hücreleri üzerindeki PD-1 moleküllerinin peptit zincirini kısaltmak için sinyal uyarıcı molekül olarak CD28-CD137'yi kullanır. Tedaviyi kaybet. Şimdiye kadar, akciğer kanseri, pankreas kanseri, kolon kanseri ve yumurtalık kanseri dahil olmak üzere tümörü olan toplam 10 hasta tedavi için gruba kaydedildi, bunlardan 2'si grup dışı idi.Tedaviden sonra 7 vaka stabil hastalık (SD) ve 1 hastalık progresyon vakası (PD) ). Test edilen tüm hastalar, sitokin fırtınası ve kemik iliği baskılanması dahil olmak üzere ciddi advers reaksiyonlara sahip değildi ve iyi biyolojik güvenlik ve tolere edilebilirliğe sahipti.
Bu araştırmanın sonuçları, Bosheng Ji'an'ın katı tümörlerinin klinik araştırmalarında bir başka önemli dönüm noktasıdır.Tamamlayıcı teknoloji ve Hefei First People's Hospital Onkoloji Bölümü ile yakın alışveriş ve işbirliği sayesinde, bu projenin kaydı, tedavisi ve hastaları garanti edilmektedir. Hastalık tespiti ve takip araştırması gibi bir dizi çalışmanın sorunsuz uygulanması. Bu teknoloji, yurtiçi ve yurtdışındaki mevcut araştırma noktalarına uyar ve yenilikçiliği ve pratikliği dünyanın önde gelen seviyesiyle uyumludur. Bu projenin uygulanması, CAR-NK hücre tedavisi için yeni çift hedefli eklem müdahale fikirleri sağlar ve tümör biyolojisi ve anti-tümör immünoterapisinin klinik dönüşümü için geniş uygulama olanakları sunar.
2. CAR-T araştırmasının kapsamı genişledi ve Çin ve Amerika Birleşik Devletleri CAR-T araştırmasının ana destekleyicileri oldu
2.1 Klinik deneylerin gelişimi bölgelerde yoğunlaşmıştır ve Çin ve Amerika Birleşik Devletleri CAR-T araştırmasının ana destekleyicileri konumundadır
Şu anda dünya çapında tescillenen CAR-T klinik denemeleri çoğunlukla Çin ve Amerika Birleşik Devletleri'nde yürütülmektedir. Bunlar arasında şu anda kayıtlı olan ve geliştirme aşamasında olan (işe alınmayan, devam eden, işe alınan, işe alınan vb. Dahil) klinik deneylerin sayısı 222'dir ve ABD'yi aşmaktadır. Dünyada birinci sırada 177 öğe. Ve bu ürünlerden bazıları klinik ilerleme kaydetti Çin ve Amerika Birleşik Devletleri'nin CAR-T alanında lider olmaya ve CAR-T'nin pazar avantajını daha da sağlamlaştırmaya devam etmesini bekliyoruz.
2.1 Erken ve orta vadeli klinik araştırmalar çoğunlukla yapılır ve hastalıkların araştırma kapsamı giderek genişlemektedir
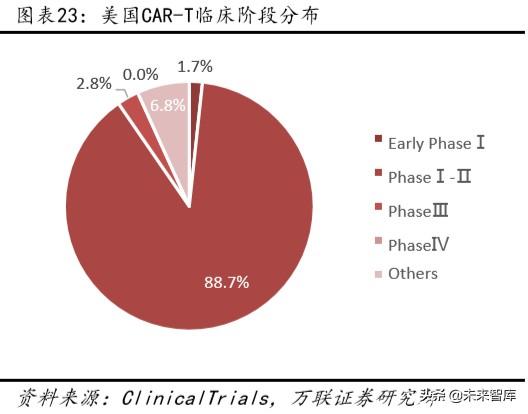
Şu anda, dünya çapında devam eden klinik araştırmaların çoğu, klinik öncesi ve klinik 1-2 aşamalarında olup, kayıtlı tüm klinik araştırmaların% 80'inden fazlasını oluşturmaktadır (devam etmektedir). Klinik araştırmalar safhası açısından bakıldığında, Çin ve Amerika Birleşik Devletleri arasında devam eden klinik araştırmaların ilerlemesinde çok az fark vardır ve her ikisi de faz 1-2 klinik araştırmalara odaklanmaktadır.
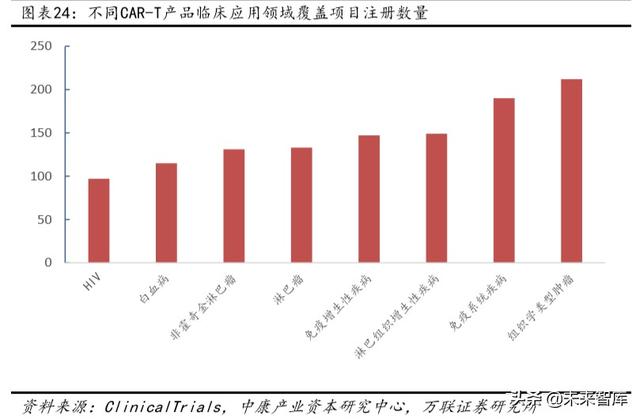
Kapsam, geçmişteki tek tümör türlerinden farklıdır, ancak ana tümör türleri, ALL, AML (akut miyeloid lösemi), ANLL (akut lenfositik olmayan lösemi) dahil olmak üzere hala hematolojik tümörlerdir. Ancak ek olarak, adenokarsinom, bronş kanseri ve karaciğer kanseri gibi katı tümörleri, lenfoproliferatif hastalıkları ve immünoproliferatif hastalıkları da kapsar. Bu, Çin ve Amerika Birleşik Devletleri'ndeki klinik deneylere yansımıştır.
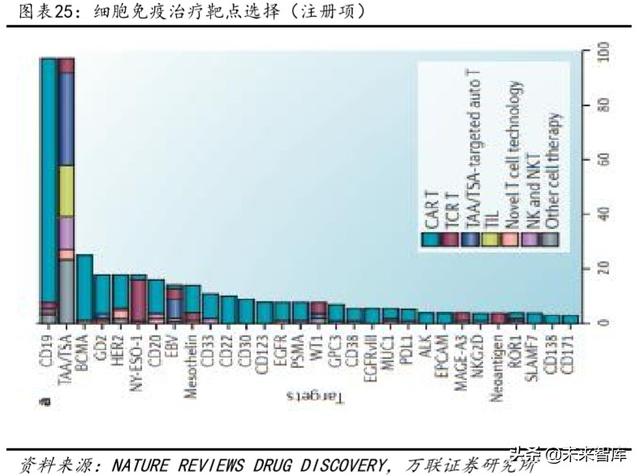
Eylem yerinde, mevcut ana site hala CD19'dur. BCMA, CD20, CD33 ve Her2 gibi hedefler de söz konusudur, ancak daha küçük sayı aynı zamanda CD19 hedefleri için rekabetin daha yoğun hale gelebileceğini gösterir.
Farklı ülkelerdeki ana kanser epidemiyolojisine göre, Çin ve Amerika Birleşik Devletleri'ndeki klinik çalışmalarda tümör türlerinin kapsama alanı yoğunluğu da farklıdır. Çin'deki akciğer kanseri ve kolon kanseri kayıtlarının sayısı Amerika Birleşik Devletleri'ninkinden daha yüksektir. Bununla birlikte, meme kanseri ve melanom araştırmalarının sayısı Amerika Birleşik Devletleri'ninkinden önemli ölçüde farklıdır.
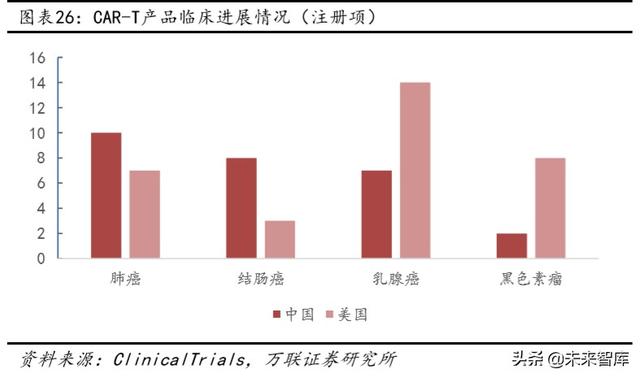
Çin'de akciğer kanseri, mide kanseri ve kolon kanseri hala en yüksek insidansa sahip tümörlerdir ve son yıllarda bariz bir değişim eğilimi yoktur. Yukarıdaki üç tümör, genel popülasyonda en yüksek insidansa sahip olmasına rağmen, meme kanseri ve merkezi sinir sistemi tümörlerinin insidansı da artmaktadır, ancak hasta sayısında hala önemli bir boşluk vardır. Bu nedenle, daha fazla klinik deney hala akciğer kanseri, kolon kanseri ve mide kanserine yöneliktir, ancak meme kanseri zaten kapsanmıştır. Amerika Birleşik Devletleri'nde Çin'den farklı olarak meme kanseri ve melanom başlıca tümörler olurken, mide kanseri ve kolon kanseri görülme sıklığı önemli ölçüde azalmıştır.Bu nedenle CAR-T tedavisi daha çok meme kanseri ve melanoma odaklıdır.
2.2 Lenfoma insidansı ve ölüm oranı yüksektir ve iç pazar geniş bir uygulama alanına sahiptir.
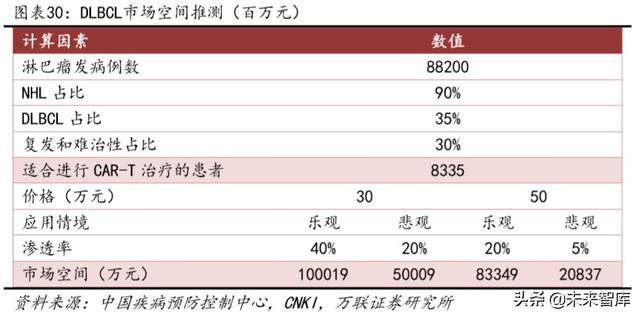
Endikasyonlar açısından, bu NDA listeleme uygulaması Çin'de Fosun Kate tarafından yürütülen tek kollu, açık, çok merkezli köprüleme klinik denemesine (FKC876-2018-001) dayanmaktadır. Refrakter agresif NHL'de (büyük B hücreli lenfoma) Bu ürünün güvenliği ve etkinliği Çinli hastalarda değerlendirilmiştir. Globalcan verilerine göre, NHL'nin Çin'deki brüt insidans oranı, dünyanın orta kesimlerinde yer alan her yaş için 100.000'de 6.2'dir Her yıl 85.000'den fazla insan hastalanır. Her yıl 25 yaşın altında yaklaşık 16.000 yeni akut lenfositoma vakası görülmektedir.
İlgili yerli epidemiyoloji, 2015 yılında yerli lenfoma hastalarının sayısının 88.200 olması beklendiğini göstermektedir. Literatüre göre, non-Hodgkin lenfoma tüm lenfomaların% 80-90'ını oluşturur ve çoğu B hücreli lenfomadır. B hücreli lenfomalar arasında en yaygın olanı diffüz büyük B hücreli lenfomadır (DLBCL) Çin'de, DLBCL tüm NHL'lerin yaklaşık% 35'ini oluşturur. Başlangıçta sadece DLBCL'nin Çin'de yılda yaklaşık 27.000 vaka olduğunu elde edebiliriz. . Literatür verilerine göre, DLBCL'deki nükseden ve refrakter oranı yaklaşık% 30'dur Ürün fiyatı 300,000 yuan olarak hesaplanırsa, genel pazar alanı yaklaşık 2,5 milyar yuan'dır. Ulusal İstatistik Bürosu tarafından açıklanan harcanabilir gelirin beşte birlik dilimlerine bakıldığında, yüksek gelir grubu ve orta-yüksek gelir grubunun tedavi için pazar nüfusu olması beklenmektedir (harcanabilir gelirin, pazar kabul nüfusu olarak 5-10 yıl içinde tedavi maliyetlerini karşılayıp karşılayamayacağını kullanıyoruz), bu nedenle Daha iyimser koşullar altında pazara giriş oranının% 40'a ulaşmasını bekliyoruz. Ürün fiyatının 500.000 yuan olduğunu varsayarsak, CAR-T penetrasyon oranının sadece karamsar% 5'i hesaplanırsa, DLBCL için pazar alanı tek başına 200 milyon yuan'ı aşacaktır.
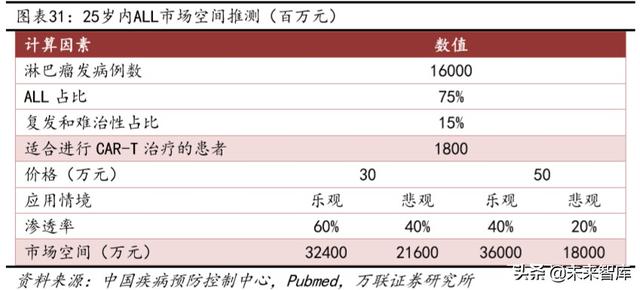
Yaygın büyük B hücreli tümörlere ek olarak, Çin'de CAR-T için en olası endikasyon akut lenfoblastik lösemidir (ALL). Ayrıca sakinlerin gelirinin beşte birine ve ürün fiyatına bağlı olarak, ürünün potansiyel pazar alanını da tahmin ediyoruz . Endikasyonları olan hastalar çocuk ve genç olduğu için ailelerin tedavi etme istekliliğinin daha güçlü olmasını bekleriz, bu nedenle pazar kabul grubu olarak 10-15 yıl içinde harcanabilir gelirin tedavi maliyetini karşılayıp karşılayamayacağını benimsiyoruz. En karamsar uygulama senaryomuzda, tedavi maliyetlerinde 300.000 yuan ve 500.000 yuan'a karşılık gelen tekrarlayan / refrakter ALL ve DLBCL için Çin'deki CAR-T için, yıllık satışların 720 milyon ve 390 milyon yuan'a ulaşması bekleniyor. .
Hematolojik tümörlere ek olarak, CAR-T tedavisi şu anda katı tümörler alanında denenmekte ve araştırılmaktadır.Sadece 2015 yılında, Çin'deki kanser hastalarının sayısının 4.292 milyona ulaşacağı tahmin edilmektedir. Teknolojinin daha da yükseltilebileceği ve endikasyonların genişletilebileceği varsayımı altında, CART uygulama pazarı Hala iyileştirme için çok yer var.
3. Yerli yenilikçi ilaçların ödeme modelini keşfedin
CAR-T ürünlerinin, tıbbi ödeme modellerine olumlu bir bakış getirmesinin beklendiğine inanıyoruz. Yenilikçi ilaçların en yoğun olduğu ABD pazarını ele aldığımızda, örneğin reçeteli ilaçlar için kendi kendine ödeme oranı 1960'lara kıyasla önemli ölçüde düştü ve kişisel sigortalar önemli bir orana sahip. Bu, Amerika Birleşik Devletleri'ndeki yenilikçi ilaçların uygulama alanını büyük ölçüde derinleştiriyor. Aynı zamanda CAR-T ürünlerinin lansmanında yabancı üreticiler de ticari sigorta ile işbirliğine büyük önem verdiler.
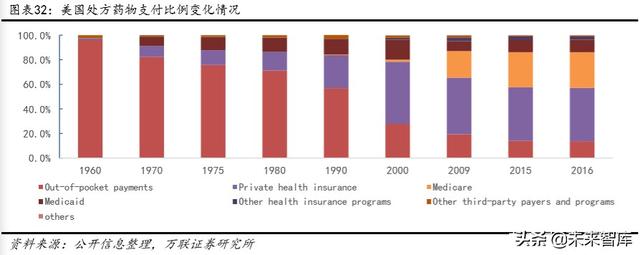
Çin'de, sağlık sigortası ödemeleri şu anda ödemelerin önemli bir bölümünü oluştururken, kişisel ödemeler ve sigorta nispeten küçük bir bölümü oluşturmaktadır. Aynı zamanda, kişi başı tıbbi harcama açısından yerel ortalama ile gelişmiş ülkeler arasında hala açık bir uçurum var. Sağlık sigortası baskısı altındaki genel endüstri bağlamında, CAR-T ürünlerinin daha fazla sigorta ve işbirliği arayışına gireceğini ve kısa vadede sağlık sigortasına girme olasılığının nispeten küçük olmasını bekliyoruz.
Bu nedenle, gişe rekorları kıran bir ürün olarak CAR-T başarılı bir şekilde listelenirse, yenilikçi ilaçlar için bir ödeme modeli keşfetmeye ve aşamalı olarak oluşturmaya yardımcı olacağına ve daha yenilikçi ilaçların da bundan fayda sağlayacağına inanıyoruz.

CAR-T ürünlerinin önemli terapötik etkileri nedeniyle, son zamanlarda Amerika Birleşik Devletleri Sağlık Sigortası ve Medicaid Hizmetleri Merkezlerinin (CMS) CAR-T tedavisi için ödeme yapmayı, yani CART için hastaneye yüzbinlerce dolar ödemeyi kabul ettiğini açıkladıklarını da belirtmek gerekir. Terapiler belirli kanser hastalarını tedavi eder. CMS, hastaneye Novartis'in CAR-T tedavisi Kymriah için 500.000 ABD doları ve hastaneye Gilead'ın CAR-T tedavisi için Yescarta için yaklaşık 400.000 ABD doları ödeyecektir. Ancak, CAR-T'nin ultra endikasyon uygulaması hariçtir. Ödeme kapsamı. CAR-T parçasının Çin'deki sağlık sigortasına dahil edilip edilemeyeceği henüz belli değil, ancak sağlık sigortası kapsamına dahil edilebilirse, CAR-T ürünlerinin pazar penetrasyonunu büyük ölçüde güçlendirecektir.
4. Politikalar ve düzenlemeler
2016'daki "Wei Zexi" olayından sonra, düzenleyici otoriteler hücresel immünoterapiye özel önem verdiler ve hücresel immünoterapinin uyumlu olmayan klinik uygulamasını durdurdular ve temel olarak CAR-T'nin uygulamasını klinik araştırma seviyesine sınırladılar. Bununla birlikte, immünoterapi teknolojisinin uygulanması son yıllarda doğru yolda ilerlediğinden, düzenleyici makamlar, hücresel immünoterapi uygulamasının rehberliğini ve düzenlemesini güçlendirmek için bir dizi ilgili politika ve yönetmelik de yayınladı. Erken Ar-Ge'den üretime, temel bilimsel araştırmalardan klinik araştırmaya kadar hücresel immünoterapi ürünlerinin tüm yönleri için düzenlemeleri mükemmelleştirdi ve ilgili ilkeleri ve temel gereksinimleri formüle etti.
5. Yatırım tavsiyesi
Mevcut bakış açısına göre, Çin'de bu aşamada listelenmek için araştırma veya uygulama aşamasındaki bir dizi CAR-T ürünü henüz performanslarına katkıda bulunamazlar Başarılı bir şekilde listelenirlerse, fiyatlandırma ve hasta yardım planları gibi pazar etkisi faktörlerinin daha kapsamlı bir şekilde değerlendirilmesi gerekir. Bununla birlikte, anti-tümör tedavisi için gişe rekorları kıran bir teknoloji uygulaması olarak, CAR-T ürünlerinin, endikasyonlarını yükseltmeye ve genişletmeye devam etmesi beklenmektedir ve bu temelde, yenilikçi ilaçların ve tümör tedavisi pazarlarının ve yenilikçi ilaç ödeme sistemlerinin araştırılması ve geliştirilmesinin dikkatini daha da çekmesi beklenmektedir. mükemmel. Her bir CAR-T ürününün takip klinik ve ticarileştirme sürecini anlamaya dayalı olarak CAR-T ve diğer yenilikçi tümör ilaç tedavilerinin endüstri stoklarına dikkat edilmesi önerilir.
...
(Rapor kaynağı: Wanlian Securities)
Raporu almak için, lütfen Future Think Tank www.vzkoo.com'da oturum açın.
Şimdi giriş yapmak için lütfen tıklayın: "bağlantı"
-

- Altın endüstrisi hakkında ayrıntılı rapor: paniğin ardından altın üzerine yeni gözlemler, daha parlak bir gelecek
-

- Maksimum değeri 14 milyar ABD doları olan 8 tek boynuzlu at, Güneydoğu Asya önümüzdeki 1 milyar mobil kullanıcıya sahip olacak
-

- Sigorta Sektörü Özel Raporu: Düşük Faiz Oranları Çağında Sigorta Sektörünün Karşılaştığı Zorluklar ve Karşı Tedbirler
-

- 2020 Çin Yarı İletken Atılım Savaşı: Sektörde Rekabet Ortamı Hakkında Derinlemesine Araştırma ve Rehberlik (Bölüm 1)
-

- İlaç endüstrisi hakkında özel rapor: karşılaştırmalı analiz, çok uluslu ilaç şirketleri ve yerel ilaç şirketleri arasındaki rekabet
-

- Paylaşılan mopedler hakkında özel rapor: mopedlerin paylaşımı artmak üzere ve pil değişim hizmetleri için geniş alan var















